
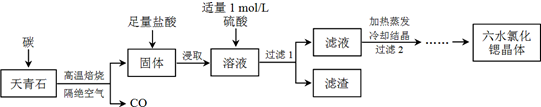
分析 以天青石(主要成分為SrSO4)為原料制備六水氯化鍶(SrCl2•6H2O),由流程可知,天青石和碳隔絕空氣高溫焙燒生成CO、SrS,SrS加鹽酸后溶液中除含有Sr2+和Cl-外,還含有少量Ba2+雜質,然后加硫酸生成硫酸鋇沉淀,所以過濾后濾渣為硫酸鋇,濾液中含SrSO4、SrCl2,最后蒸發、冷卻結晶得到SrCl2•6H2O,以此來解答.
解答 解:(1)研磨粉碎的目的是增加反應物的接觸面積,提高反應速率,提高原料的轉化率,故答案為:增加反應物的接觸面積,提高反應速率,提高原料的轉化率;
(2)由SrSO4中只有S被還原,且1mol SrSO4反應電子轉移8mol,則該反應的化學方程式為SrSO4+4C $\frac{\underline{\;高溫\;}}{\;}$ SrS+4CO↑,
故答案為:SrSO4+4C $\frac{\underline{\;高溫\;}}{\;}$ SrS+4CO↑;
(3)由上述分析可知,濾渣為BaSO4,故答案為:BaSO4;
(4)①洗滌氯化鍶晶體最好選用飽和氯化鍶溶液,是因飽和氯化鍶溶液既溶解晶體表面附著的雜質,又減少洗滌時氯化鍶因溶解造成的損失,
故答案為:既溶解晶體表面附著的雜質,又減少洗滌時氯化鍶因溶解造成的損失;
②六水氯化鍶晶體61℃時開始失去結晶水,100℃時失去全部結晶水,則用熱風吹干六水氯化鍶,選擇的適宜溫度范圍是50~60℃,故答案為:A;
(5)0.2000mol/L的NH4SCN標準溶液滴定剩余的AgNO3,Ag+以AgSCN白色沉淀的形式析出,則用含Fe3+的溶液作指示劑,當標準液過量時Fe3+、SCN-結合生成絡離子,溶液為血紅色,所以滴定達到終點的現象是溶液由無色變為血紅色,且30s不褪色,故答案為:溶液由無色變為血紅色,且30s不褪色.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備流程中發生的化學反應及物質分離方法為解答的關鍵,涉及反應速率、氧化還原反應、滴定原理等,注意信息與所學知識的綜合應用,綜合性較強,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| 藥品柜 | 甲 | 乙 | 丙 | 丁 |
| 藥品 | 硫黃、紅磷 | 鎂、鋅 | 硫酸、硝酸 | 氫氧化鈉、氫氧化鈣 |
| A. | 甲柜 | B. | 乙柜 | C. | 丙柜 | D. | 丁柜 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
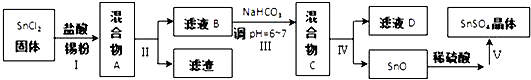
查看答案和解析>>
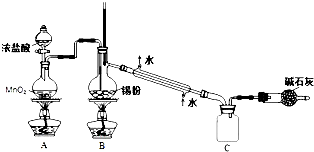
科目:高中化學 來源: 題型:實驗題
 $→_{△}^{濃H_{2}SO_{4}}$
$→_{△}^{濃H_{2}SO_{4}}$ +H2O
+H2O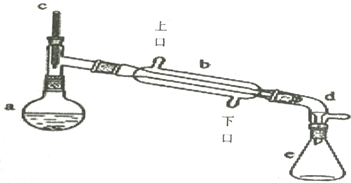
| 相對分子質量 | 密度/(g.cm-3) | 沸點/℃ | 溶解性 | |
| 環己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 環己烯 | 82 | 0.8102 | 83 | 難溶于水 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都隨溫度的升高而增大 | |
| B. | 結構式為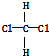 和 和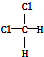 的物質互為同分異構體 的物質互為同分異構體 | |
| C. | 根據反應:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的強弱的順序為:H2CO3>HA>HCO3->HB | |
| D. | 過硼酸鈉晶體(NaBO3•4H2O)是一種優良的漂白劑,在70℃以上加熱該晶體30.80克,反應后稱量固體質量為27.20克,則該固體物質的化學式為NaBO3•H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
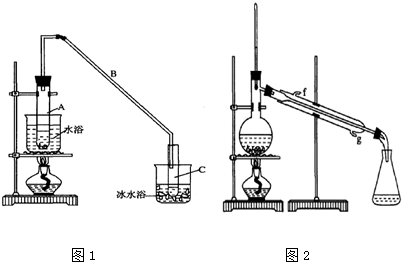

| 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
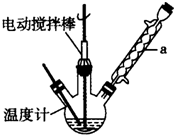 甲苯(
甲苯(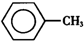 )是一種重要的化工原料,能用于生產苯甲醛(
)是一種重要的化工原料,能用于生產苯甲醛(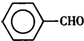 )、苯甲酸(
)、苯甲酸(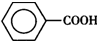 )等產品.下表列出了有關物質的部分物理性質,請回答:
)等產品.下表列出了有關物質的部分物理性質,請回答:| 名稱 | 性狀 | 熔點(℃) | 沸點(℃) | 相對密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 無色液體易燃易揮發 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 無色液體 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片狀或針狀晶體 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反應的原子利用率理論上可達66.25%.【原子利用率=$\frac{期望產物的總質量}{全部反應物的總質量}$×100%】
,此反應的原子利用率理論上可達66.25%.【原子利用率=$\frac{期望產物的總質量}{全部反應物的總質量}$×100%】查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
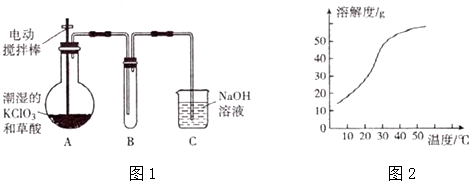
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 氧化性強弱:F2<Cl2 | B. | 金屬性強弱:Al<Na | ||
| C. | 酸性強弱:H2CO3<HNO3 | D. | 堿性強弱:NaOH<Mg(OH)2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com