
| A. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,都隨溫度的升高而增大 | |
| B. | 結構式為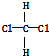 和 和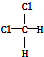 的物質互為同分異構體 的物質互為同分異構體 | |
| C. | 根據反應:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的強弱的順序為:H2CO3>HA>HCO3->HB | |
| D. | 過硼酸鈉晶體(NaBO3•4H2O)是一種優良的漂白劑,在70℃以上加熱該晶體30.80克,反應后稱量固體質量為27.20克,則該固體物質的化學式為NaBO3•H2O |
分析 A.若升高溫度后平衡向著逆向移動,則平衡常數會減小;
B.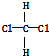 和
和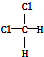 的分子式組成、結構完全相同,為同一種物質;
的分子式組成、結構完全相同,為同一種物質;
C.根據強酸制取弱酸原理分析;
D.過硼酸鈉晶體(NaBO3•4H2O)的物質的量=$\frac{30.8g}{154g/mol}$=0.2mol,70℃以上質量變化為27.20g,質量變化30.8g-27.20g=3.6g,減少水的質量=$\frac{3.6g}{18g/mol}$=0.2mol,據此分析判斷得到化學式.
解答 解:A.對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和用平衡分壓表示的平衡常數,其數值不同,但意義相同,但是溫度升高后平衡常數不一定增大,如放熱反應中,升高溫度后平衡向著逆向移動,平衡常數減小,故A錯誤;
B.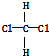 和
和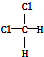 中氯原子連接在同一碳原子上,為四面體構型,不存在同分異構體,為同一物質,故B錯誤;
中氯原子連接在同一碳原子上,為四面體構型,不存在同分異構體,為同一物質,故B錯誤;
C.根據反應NaA+CO2(少量)+H2O═HA+NaHCO3可知酸性H2CO3>HA,根據反應2NaB+CO2+H2O═2HB+Na2CO3可知酸性HCO3->HB,則酸的強弱的順序為:H2CO3>HA>HCO3->HB,故C正確;
D.過硼酸鈉晶體(NaBO3•4H2O)的物質的量=$\frac{30.8g}{154g/mol}$=0.2mol,70℃以上質量變化為27.20g,質量變化30.8g-27.20g=3.6g,減少水的質量=$\frac{3.6g}{18g/mol}$=0.2mol,則1molNaBO3•4H2O失去水1mol,則T2℃時所得晶體的化學式為NaBO3•3H2O,故D錯誤;
故選C.
點評 本題考查較為綜合,涉及化學平衡的影響因素、酸性強弱比較、同分異構體判斷、分子式確定的計算等知識,題目難度中等,注意掌握同分異構體的概念及判斷方法,A為易錯點,注意溫度升高后平衡常數不一定增大,試題培養了學生的靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 在輪船水線以下的船體裝上一定數量的鋅塊 | |
| B. | 在金屬表面進行電鍍 | |
| C. | 在一定條件下對金屬進行處理,在其表面形成一層致密的氧化膜 | |
| D. | 將鐵閘門與直流電源的正極相連 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鈷(Co)及其化合物在磁性材料、電池材料、超硬材料及催化劑等領域有廣泛應用.已知鈷屬于鐵系元素,其單質與化合物的性質與鐵相似,其常見化合價有+2和+3.請回答下列問題:
鈷(Co)及其化合物在磁性材料、電池材料、超硬材料及催化劑等領域有廣泛應用.已知鈷屬于鐵系元素,其單質與化合物的性質與鐵相似,其常見化合價有+2和+3.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
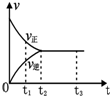 如圖是可逆反應N2(g)+3H2(g)?2NH3(g)在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述正確的是( )
如圖是可逆反應N2(g)+3H2(g)?2NH3(g)在反應過程中的反應速率(v)與時間(t)的關系曲線,下列敘述正確的是( )| A. | t1時,只有正反應在不斷進行,速率在逐漸減小 | |
| B. | t2時,反應到達限度,在此條件下N2的轉化率達到最大 | |
| C. | t2-t3,反應不再發生,各物質的物質的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物質的量濃度相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
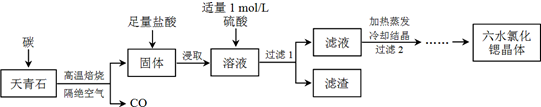
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
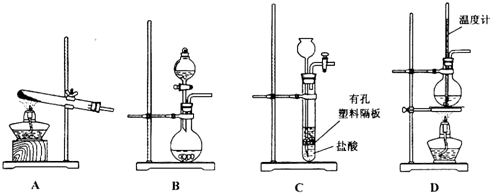
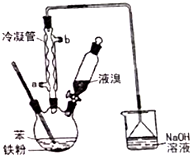 溴苯是一種化工原料,實驗室用苯和液溴合成溴苯的裝置示意圖如圖.(夾持儀器已略去)
溴苯是一種化工原料,實驗室用苯和液溴合成溴苯的裝置示意圖如圖.(夾持儀器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反應過程中燒瓶內有白霧產生,是因為生成HBr了氣體.
+HBr,反應過程中燒瓶內有白霧產生,是因為生成HBr了氣體.| 苯 | 溴苯 | |
| 沸點/℃ | 80 | 156 |
| 水中溶解度 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
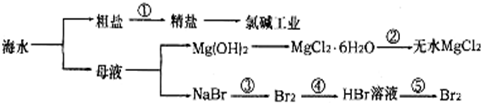
| A. | 過程①需要加入化學試劑、沉淀、過濾等操作 | |
| B. | 由“母液→無水MgCl2”一系列變化中未涉及氧化還原反應 | |
| C. | 工業上一般用電解氯化鎂溶液制取Mg單質 | |
| D. | 反應③和⑤均可由下列反應實現:2Br-+Cl2=Br2+2Cl-,該反應屬于置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大反應體系的壓強,平衡后SO2的濃度、轉化率、體積分數都增加 | |
| B. | 當單位時間內消耗SO2的物質的量和生成SO3的物質的量相同時,反應達到平衡狀態 | |
| C. | 充入SO3氣體,體系壓強增大,平衡向右移動 | |
| D. | 升高溫度,平衡向左移動 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com