
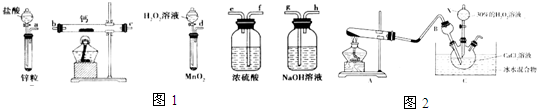
分析 (1)一般制備純凈干燥的氣體的實驗裝置的順序為:制備裝置→除雜裝置→干燥裝置等;
(2)實驗結束時為防止空氣進入裝置,還要繼續通氧氣直到裝置冷卻;
(3)①根據裝置圖可知,A是用氯化銨與氫氧化鈣加熱制氨氣,據此書寫化學方程式;
②由于過氧化氫和Ca2+反應會產生氫離子,用氨氣中和氫離子,可以促使反應正向進行;
③反應結束后,經過濾、洗滌、低溫烘干可獲得CaO2.8H2O,通過檢驗洗滌濾液中是否有氯離子判斷CaO2.8H2O是否洗滌干凈;
④結合題意可知,氧氣的質量為mg-ng,根據反應2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑可求得過氧化鈣的質量,進而確定質量分數.
解答 解:(1)制備過氧化鈣時,用雙氧水制備氧氣,鈣屬于極活潑的金屬,極易與水反應生成氫氧化鈣和氫氣,而制備的氧氣中會混有水蒸氣,所以在與鈣化合之前需要干燥,選用試劑是濃硫酸;同時為防止空氣中水蒸氣進入,最后還需要連接濃硫酸的洗氣瓶,所以正確的順序為:dfebcf或dfecbf;
故答案為:dfebcf或dfecbf;
(2)實驗結束時為防止空氣進入裝置,還要繼續通氧氣直到裝置冷卻,所以實驗結束時的操作為熄滅酒精燈,待反應管冷卻至室溫,停止通入氧氣,并關閉分液漏斗的活塞,
故答案為:熄滅酒精燈,待反應管冷卻至室溫,停止通入氧氣,并關閉分液漏斗的活塞;
(3)①根據裝置圖可知,A是用氯化銨與氫氧化鈣加熱制氨氣,反應的化學方程式為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②由于過氧化氫和Ca2+反應會產生氫離子,用氨氣中和氫離子,可以促使反應正向進行,所以氨氣的作用為中和過氧化氫和Ca2+反應析出的氫離子,促進反應進行(或使溶液呈堿性,減少CaO2•8H2O的溶解,或提高產品的產率),
故答案為:中和過氧化氫和Ca2+反應析出的氫離子,促進反應進行(或使溶液呈堿性,減少CaO2•8H2O的溶解,或提高產品的產率);
③反應結束后,經過濾、洗滌、低溫烘干可獲得CaO2.8H2O,通過檢驗洗滌濾液中是否有氯離子判斷CaO2.8H2O是否洗滌干凈,操作為取最后的洗滌液少許于試管中,先加入稀硝酸酸化,再滴加硝酸銀溶液,若沒有白色沉淀生成,則說明已經洗滌干凈;反之則說明未洗滌干凈,
故答案為:取最后的洗滌液少許于試管中,先加入稀硝酸酸化,再滴加硝酸銀溶液,若沒有白色沉淀生成,則說明已經洗滌干凈,反之則說明未洗滌干凈;
④結合題意可知,氧氣的質量為mg-ng,根據反應2CaO2$\frac{\underline{\;350℃\;}}{\;}$2CaO+O2↑可求得過氧化鈣的質量為(m-n)g×$\frac{72×2}{32}$=4.5(m-n)g,所以產品中CaO2的質量分數為:$\frac{4.5(m-n)g}{mg}$×100%=$\frac{9(m-n)}{2m}$×100%,
故答案為:$\frac{9(m-n)}{2m}$×100%.
點評 本題考查實驗方案的設計、物質組成及含量測定計算,題目難度中等,明確實驗目的和實驗原理為解答關鍵,注意掌握性質實驗方案設計的與評價原則,明確探究物質組成及含量測定的方法,試題充分考查學生的分析理解能力及知識遷移應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題

| A. | 正極反應為:Zn-2e-═Zn2+ | |
| B. | 電池反應為:Zn+Cu2+═Zn2++Cu | |
| C. | 在外電路中,電子從銅電極流向鋅電極 | |
| D. | 鹽橋中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
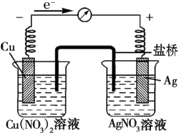 某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.
某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶在使用之前要檢漏 | |
| B. | 容量瓶上有溫度,濃度,標線三個標識 | |
| C. | 定容時,因不慎使液面高于容量瓶的刻度線,可用滴管將多余液體吸出 | |
| D. | 配置好的溶液儲存在容量瓶中,并貼上標簽 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
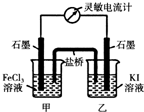 常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2
常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2查看答案和解析>>
科目:高中化學 來源: 題型:解答題
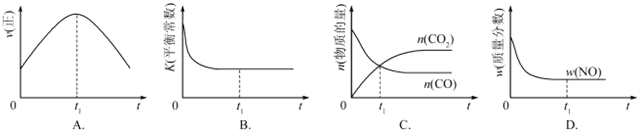
| 溫度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常數 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
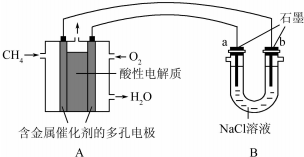
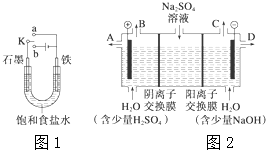 (1)某課外活動小組同學用圖1裝置進行實驗,試回答下列問題:
(1)某課外活動小組同學用圖1裝置進行實驗,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子.
A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
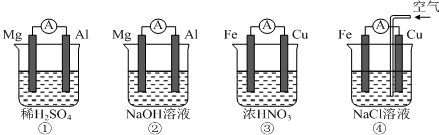
| A. | ①中Mg作負極,電子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作負極,OH?遷移方向:Al→外電路→Mg | |
| C. | ③中Fe作正極,電極反應式:2H++2e?═H2↑ | |
| D. | ④中Cu作正極,電極反應式:O2+4e?+2H2O═4OH? |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com