
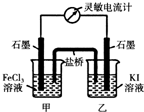
 常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2
常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2分析 (1)KSCN溶液是檢驗Fe3+的試劑,通過三價鐵離子是否剩余來判斷KI溶液和FeCl3溶液反應的限度;
(2)①反應達到平衡時,正逆反應速率相等,沒有電子發生轉移,即:電流計讀數為零;
②反應達到平衡后,向甲中加入適量FeCl2固體,Fe2+濃度增大,平衡逆向移動,則Fe2+失去電子生成Fe3+.
解答 解:(1)可以用KSCN溶液,來檢驗三價鐵離子是否剩余,取上層溶液,滴加KSCN試劑,如果溶液顯紅色,說明三價鐵剩余,KI溶液和FeCl3溶液反應不徹底,反之則進行徹底;
故答案為:上層溶液呈紅色;
(2)①a、當電流計為零時,說明沒有電子發生轉移,則反應達到平衡,故a正確;
b.電流計指針不再偏轉且不為零,說明反應勻速進行,未達平衡,故b錯誤;
c.電流計指針偏轉角度最大,說明反應正在進行,未達平衡,速率達最大值,故c錯誤;
d.甲燒杯中溶液顏色不再改變,說明各物質濃度不在改變,已達平衡,故d正確;
故答案為:ad;
②反應達到平衡后,向甲中加入適量FeCl2固體,Fe2+濃度增大,平衡逆向移動,則Fe2+失去電子生成Fe3+,發生反應:2Fe2+-2e-=2Fe3+,甲為負極,
故答案為:甲;2Fe2+-2e-=2Fe3+.
點評 本題考查了原電池原理和化學平衡移動,題目難度中等,明確原電池工作原理、化學平衡及其影響因素是解題的關鍵,試題側重考查學生的分析、理解能力及化學實驗能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
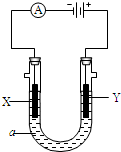 電解原理在化學工業中有廣泛應用,如圖為工業制氯氣的裝置原理.U型管中裝有電解液a;X、Y是兩根電極棒,通過導線與直流電源相連,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:
電解原理在化學工業中有廣泛應用,如圖為工業制氯氣的裝置原理.U型管中裝有電解液a;X、Y是兩根電極棒,通過導線與直流電源相連,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
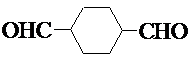 .
.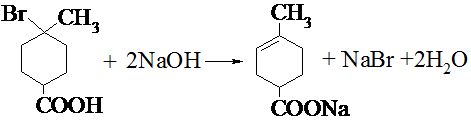 .
.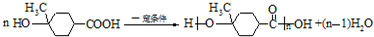 .
.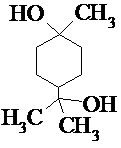 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
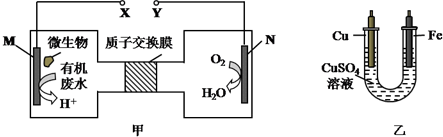
| A. | H十透過質子交換膜由右向左移動 | |
| B. | 銅電極應與X相連接 | |
| C. | M電極反應式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 當N電極消耗0.25mol氣體時,則鐵電極增重16g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
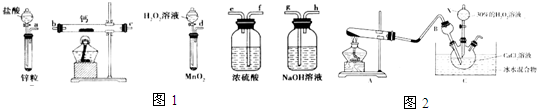
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中的OH-向正極移動 | |
| B. | 在銀表面上的反應為:2Al+3Ag2S═6Ag+Al2S3 | |
| C. | 正極反應式為:Ag2S+2e-═2Ag+S2- | |
| D. | 在鋁表面的反應為:Al+3OH--3e-═Al(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
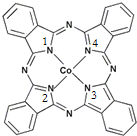 鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題:
鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題: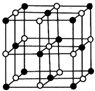 ,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.
,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.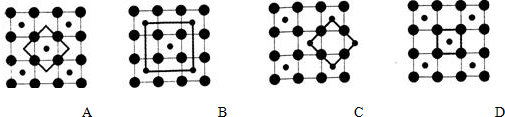
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com