
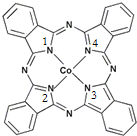
 鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題:
鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題: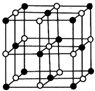 ,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.
,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.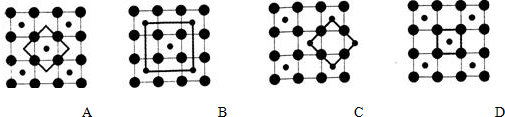
分析 (1)Co為27號元素,原子核外電子數為27,根據能量最低原理書寫核外電子排布式;
(2)①酞菁鈷中三種非金屬原子為C、N、H,同周期自左而右電負性增大,非金屬性越強電負性越大;分子中C原子均形成3個σ鍵,沒有孤對電子,雜化軌道數目為3;
②含有孤對電子的N原子與Co通過配位鍵結合,形成配位鍵后形成4對共用電子對,形成3對共用電子對的N原子形成普通的共價鍵;
(3)通過顏色的變化可以表征硅膠的吸濕程度;
(4)[Co(CN)6]4-配離子具有強還原性,在加熱時能與水反應生成淡黃色[Co(CN)6]3-,只能是水中氫元素被還原為氫氣,根據電荷守恒有氫氧根離子生成;
(5)由氧化物晶胞結構可知晶胞中Co、O原子數目之比為1:1,假設黑色球為Co原子,以頂點Co原子為研究對象,與之等距離且最近的鈷原子位于面心,每個頂點為8個晶胞共用,每個面心為2個晶胞共用;
CoO2的重復結構單元示意圖中Co、O原子數目之比應為1:2,結合均攤法計算判斷.
解答 解:(1)Co為27號元素,原子核外電子數為27,根據能量最低原理,其核外電子排布式為:1s22s22p63s23p63d74s2,
故答案為:1s22s22p63s23p63d74s2;
(2)①酞菁鈷中三種非金屬原子為C、N、H,同周期自左而右電負性增大,非金屬性越強電負性越大,故電負性N>C>H;分子中C原子均形成3個σ鍵,沒有孤對電子,雜化軌道數目為3,碳原子的雜化軌道類型為 sp2,
故答案為:N>C>H;sp2;
②含有孤對電子的N原子與Co通過配位鍵結合,形成配位鍵后形成4對共用電子對,形成3對共用電子對的N原子形成普通的共價鍵,1號、3號N原子形成3對共用電子對為普通共價鍵,2號、4號N原子形成4對共用電子對,與Co通過配位鍵結合,
故答案為:2,4;
(3)隨著硅膠的吸濕和再次烘干,二氯化鈷在結晶水合物和無水鹽間轉化,通過顏色的變化可以表征硅膠的吸濕程度,
故答案為:隨著硅膠的吸濕和再次烘干,二氯化鈷在結晶水合物和無水鹽間轉化,通過顏色的變化可以表征硅膠的吸濕程度;
(4)[Co(CN)6]4-配離子具有強還原性,在加熱時能與水反應生成淡黃色[Co(CN)6]3-,只能是水中氫元素被還原為氫氣,根據電荷守恒有氫氧根離子生成,該反應離子方程式為:2[Co(CN)6]4-+2H2O=2[Co(CN)6]3-+H2↑+2OH -,
故答案為:2[Co(CN)6]4-+2H2O=2[Co(CN)6]3-+H2↑+2OH -;
(5)由氧化物晶胞結構可知晶胞中Co、O原子數目之比為1:1,假設黑色球為Co原子,以頂點Co原子為研究對象,與之等距離且最近的鈷原子位于面心,每個頂點為8個晶胞共用,每個面心為2個晶胞共用,在該晶體中與一個鈷原子等距離且最近的鈷原子數目為$\frac{3×8}{2}$=12;
CoO2的重復結構單元示意圖中Co、O原子數目之比應為1:2,由圖象可知:
A中Co、O原子數目之比為1:4×$\frac{1}{2}$=1:2,符合,
B中Co、O原子數目之比為(1+4×$\frac{1}{4}$):4=1:2,符合,
C中Co、O原子數目之比為4×$\frac{1}{4}$:4×$\frac{1}{2}$=1:2,符合,
D中Co、O原子數目之比為1:4×$\frac{1}{4}$=1:1,不符合,
故答案為:12;D.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、配合物、晶胞計算等,側重考查學生對知識的理解與遷移應用,注意利用均攤法進行晶胞計算,理解配位鍵形成條件.


科目:高中化學 來源: 題型:選擇題
 某實驗興趣小組設計如下微型實驗裝置,a、b為直流電源的兩極.實驗時,若斷開K1,閉合K2,兩極均有氣泡產生,下列有關描述正確的是( )
某實驗興趣小組設計如下微型實驗裝置,a、b為直流電源的兩極.實驗時,若斷開K1,閉合K2,兩極均有氣泡產生,下列有關描述正確的是( )| A. | 斷開K1閉合K2時,總反應的離子方程式為:2H++2Cl-$\stackrel{電解}{→}$ H2↑+Cl2↑ | |
| B. | 斷開K1閉合K2時,電子沿“a→Fe→電解質溶液→C→b”的路徑流動 | |
| C. | 斷開K1閉合K2時,鐵電極附近溶液pH逐漸升高 | |
| D. | 斷開K2閉合K1時,Fe電極被保護,此法稱為犧牲陽極的陰極保護法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
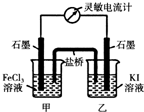 常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2
常溫下,將FeCl3溶液和KI溶液混合,發生如下反應:2Fe3++2I-?2Fe2++I2查看答案和解析>>
科目:高中化學 來源: 題型:解答題
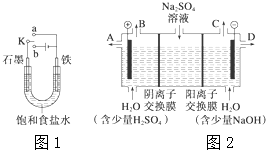 (1)某課外活動小組同學用圖1裝置進行實驗,試回答下列問題:
(1)某課外活動小組同學用圖1裝置進行實驗,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg、Al在空氣中性質穩定,因而都具有很強的抗腐蝕性 | |
| B. | 質量數相等的不同核素,一定屬于不同種元素 | |
| C. | 生石灰、鐵粉、硅膠是食品包裝中常用的干燥劑 | |
| D. | 自行車鋼架生銹主要是化學腐蝕所致 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子.
A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 最近報道了一種新型可充電式鋁電池.電解質為陽離子(EMl+)與陰離子(AlCl4-)組成的離子液體.如圖為該電池放電過程示意圖,Cn為石墨烯,下列說法不正確的是( )
最近報道了一種新型可充電式鋁電池.電解質為陽離子(EMl+)與陰離子(AlCl4-)組成的離子液體.如圖為該電池放電過程示意圖,Cn為石墨烯,下列說法不正確的是( )| A. | 充電時,每生成1mol Al,電解質溶液中會增加7molAlCl4- | |
| B. | 放電時,電解質中的陽離子(EMl+)未發生反應 | |
| C. | 放電時,負極反應方程式為Al+7AlCl4--3e-═4Al2Cl7- | |
| D. | 充電時,Cn為陽極,電極方程式為Cn+AlCl4--e-═Cn[AlCl4] |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L CHCl3含氯原子數為3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氫原子數為0.4NA | |
| C. | 常溫常壓下,11.2g乙烯中共用電子對數為2.4NA | |
| D. | 6.4 g CaC2晶體中所含的離子總數為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{高溫}{→}$MgO$\stackrel{電解}{→}$Mg | |
| B. | 石油$\stackrel{裂解}{→}$$\stackrel{分餾}{→}$苯、甲苯、二甲苯、酚等 | |
| C. | 鋁土礦$\stackrel{NaOH}{→}$$\stackrel{過濾}{→}$$\stackrel{鹽酸}{→}$$\stackrel{過濾}{→}$Al(OH)3$\stackrel{灼燒}{→}$Al2O3$\stackrel{電解}{→}$Al | |
| D. | 海洋生物$\stackrel{灼燒}{→}$$\stackrel{浸取}{→}$$\stackrel{Cl_{2}}{→}$$\stackrel{萃取}{→}$$\stackrel{分離提純}{→}$I2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com