
 A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子.
A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素.A、C的最外層電子數都是其電子層數的2倍,B的電負性大于C,透過藍色鈷玻璃觀察E的焰色反應為紫色,F的基態原子中有4個未成對電子. .
.分析 A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素;A、C的最外層電子數都是其電子層數的2倍,則A是C元素,C是S元素,透過藍色鈷玻璃觀察E的焰色反應為紫色,E是K元素,D的原子序數介于S與K元素之間,故D為Cl元素,B的電負性大于C,且B的原子序數小于C,屬于不同主族,所以B是N元素;F位于第四周期,基態原子中有4個未成對電子,外圍電子排布為3d64s2,則F是Fe元素,據此進行解答.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,它們的核電荷數依次增大,其中A、B、C、D、E為不同主族的元素;A、C的最外層電子數都是其電子層數的2倍,則A是C元素,C是S元素,透過藍色鈷玻璃觀察E的焰色反應為紫色,E是K元素,D的原子序數介于S與K元素之間,故D為Cl元素,B的電負性大于C,且B的原子序數小于C,屬于不同主族,所以B是N元素;F位于第四周期,基態原子中有4個未成對電子,外圍電子排布為3d64s2,則F是Fe元素.
(1)基態的Fe3+核外電子排布式為:1s22s22p63s23p63d6 或[Ar]3d6,故答案為:1s22s22p63s23p63d6 或[Ar]3d6;
(2)B的氣態氫化物為NH3,A、C的氣態氫化物分別為CH4、H2S,NH3與H2O分子間存在氫鍵,而CH4、H2S不能與水分子形成氫鍵,故NH3在水中的溶解度遠大于CH4、H2S,
故答案為:NH3與H2O分子間存在氫鍵,CH4、H2S分子與H2O分子間不存在氫鍵;
(3)化合物FeCl3是棕色固體、易潮解、100℃左右時升華,熔沸點低,屬于分子晶體,化合物KSCN中的陰離子與CS2互為等電子體,該陰離子的電子式是 ,
,
故答案為:分子晶體; ;
;
(4)該$\frac{1}{8}$晶胞中含有Fe2+:4×$\frac{1}{8}$=$\frac{1}{2}$;含Fe3+:4×$\frac{1}{8}$=$\frac{1}{2}$;含CN-:12×$\frac{1}{4}$=3.根據化合價代數和為0的原則,該$\frac{1}{8}$晶胞中含有K+:3-($\frac{1}{2}$×2+$\frac{1}{2}$×3)=$\frac{1}{2}$,則一個晶胞中K+的個數為$\frac{1}{2}$×8=4,
故答案為:4;
(5)FeCl3與KSCN得到含多種配合物的血紅色溶液,其中配位數為5的配合物的化學式是:K2Fe(SCN)5,故答案為:K2Fe(SCN)5.
點評 本題考查位置、結構與性質關系的綜合應用,涉及核外電子排布、氫鍵、晶體類型與性質、等電子體、配合物、晶胞計算等,題目難度中等,明確原子結構與元素周期律、元素周期表的關系為解答關鍵,(4)中注意利用均攤法進行計算.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
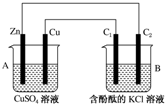 按如圖所示裝置進行實驗,并回答下列問題:
按如圖所示裝置進行實驗,并回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
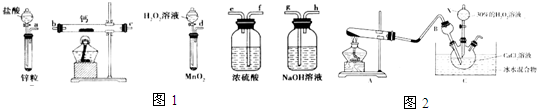
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵表面鍍銅,表面有劃損時,也能阻止鐵被氧化 | |
| B. | 在空氣中金屬鋁表面迅速被氧化形成保護膜 | |
| C. | 鐵絲與濃硫酸在常溫下鈍化 | |
| D. | 在鐵與稀H2SO4反應時,加幾滴CuSO4溶液,可加快H2的產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
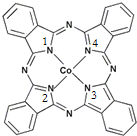 鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題:
鈷(Co)是人體必需的微量元素.含鈷化合物作為顏料,具有悠久的歷史,在機械制造、磁性材料等領域也具有廣泛的應用.請回答下列問題: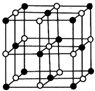 ,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.
,在該晶體中與一個鈷原子等距離且最近的鈷原子有12個;筑波材料科學國家實驗室一個科研小組發現了在 5K 下呈現超導性的晶體,該晶體具有CoO2的層狀結構(如下圖所示,小球表示Co原子,大球表示O原子).下列用粗線畫出的重復結構單元示意圖不能描述CoO2的化學組成的是D.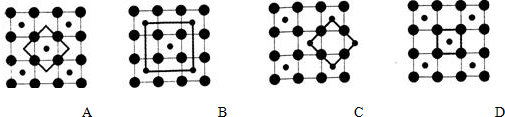
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氮原子的質量就是氮的相對原子質量 | |
| B. | 氦氣的摩爾質量是8g•mol-1 | |
| C. | 1molH2SO4中含1molH2 | |
| D. | 1molH2O的質量是18g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
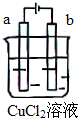
| A. | 電極a表面呈紅色 | |
| B. | 電極b表面有氣泡生成 | |
| C. | 電子由電源的負極沿導線流向電極b | |
| D. | 該裝置能量轉化形式為化學能轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
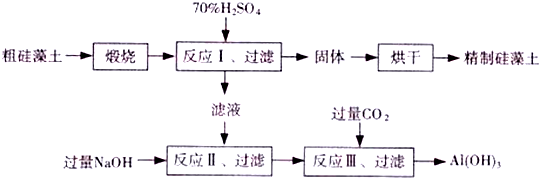
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
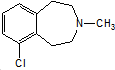 )一種治療心血管和高血壓的藥物,可由化合物B(
)一種治療心血管和高血壓的藥物,可由化合物B( )通過以下路線合成:
)通過以下路線合成: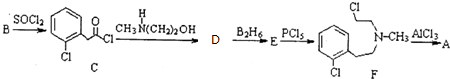
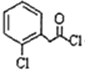 +CH3NH(CH2)2OH→
+CH3NH(CH2)2OH→ +HCl.
+HCl. .由F生成A的反應類型為取代反應.
.由F生成A的反應類型為取代反應. 或
或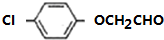 .
.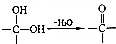 .寫出以
.寫出以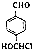 為原料制備化合物
為原料制備化合物 的合成路線流程圖.
的合成路線流程圖. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com