

| A. | 正極反應為:Zn-2e-═Zn2+ | |
| B. | 電池反應為:Zn+Cu2+═Zn2++Cu | |
| C. | 在外電路中,電子從銅電極流向鋅電極 | |
| D. | 鹽橋中的K+移向ZnSO4溶液 |
分析 銅鋅原電池中,鋅較活潑,為原電池的負極,發生Zn-2e-=Zn2+,銅為正極,發生Cu2++2e-=Cu,原電池工作時,電子從電池負極經外電路流向正極,溶液中陽離子向正極移動,以此解答該題
解答 解:A.正極上銅離子得電子生成Cu,正極反應為Cu2++2e-=Cu,故A錯誤;
B.電池總反應為鋅置換出銅,為Zn+Cu2+=Zn2++Cu,故B正確;
C.電子從電池負極經外電路流向正極,即電子從鋅電極流向銅電極,故C錯誤;
D.溶液中陽離子向正極移動,則鹽橋中的K+移向CuSO4溶液,故D錯誤;
故選B.
點評 本題考查原電池的工作原理,注意把握原電池的工作原理以及電極方程式的書寫,題目難度不大,注意電子流向和離子流向的判斷.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
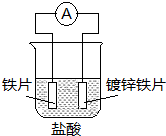
| A. | 溶液中pH值明顯下降 | B. | 陰極的電極反應式:Fe-2e→Fe2+ | ||
| C. | 鐵片為正極,鍍鋅鐵片為負極 | D. | 電子由鋅經溶液流向鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
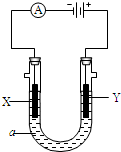 電解原理在化學工業中有廣泛應用,如圖為工業制氯氣的裝置原理.U型管中裝有電解液a;X、Y是兩根電極棒,通過導線與直流電源相連,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:
電解原理在化學工業中有廣泛應用,如圖為工業制氯氣的裝置原理.U型管中裝有電解液a;X、Y是兩根電極棒,通過導線與直流電源相連,實驗開始時,同時在兩邊各滴入幾滴酚酞試液.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯堿工業是電解熔融的NaCl,陽極產生Cl2 | |
| B. | 氫氧燃料電池可將熱能直接轉化為電能 | |
| C. | 原電池工作時,電子從負極經外電路移向正極 | |
| D. | 工業上電解熔融的AlCl3來制取鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
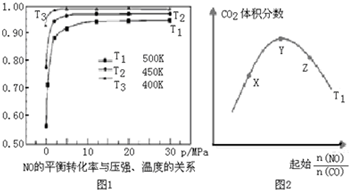
 人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注.CO2和H2在一定條件下反應生成甲醇(CH3OH)等產生,工業上利用該反應合成甲醇.
人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注.CO2和H2在一定條件下反應生成甲醇(CH3OH)等產生,工業上利用該反應合成甲醇.| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
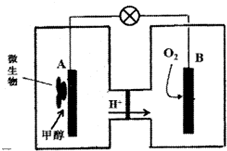
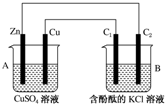 按如圖所示裝置進行實驗,并回答下列問題:
按如圖所示裝置進行實驗,并回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
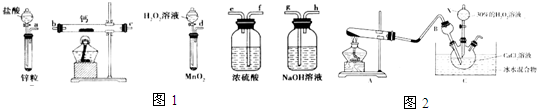
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com