
分析 (1)根據蓋斯定律,反應②×2-③即得,確定反應④2CO(g)+2NO(g)?N2(g)+2CO2(g),據此計算焓變;
(2)根據反應①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
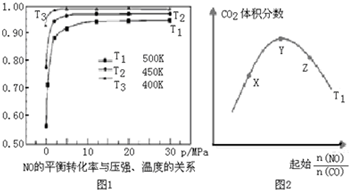
(3)化學反應達到化學平衡狀態時,正逆反應速率相等,且不等于0,各物質的濃度不再發生變化,由此衍生的一些物理量不發生變化,以此進行判斷,得出正確結論(4)根據圖象分析,常壓下NO的轉化率已經較高,并且高壓轉化率增加不大,但增加成本較大,據此分析;
(5)①溫度一定,隨反應物NO、CO的起始物質的量比增大,X-Y反應正向進行,一氧化碳的轉化率X<Y,Y-Z平衡正向進行,一氧化氮增大會提高一氧化碳的轉化率,則Y<Z;
②根據圖象1分析,溫度越低NO的平衡轉化率越大,說明該反應為放熱反應,所以溫度越低,平衡時二氧化碳的體積分數也越大,據此畫圖;
解答 解:(1)根據蓋斯定律,反應②×2-③即得,確定反應④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4=(2c-a)KJ/mol,
故答案為:2c-a;
(2)根據反應①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$,
故答案為:$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)A.單位時間內生成1mol NO2的同時消耗了lmol NO,都是正反應,故不能說明達到平衡狀態,故A錯誤;
B.密度=$\frac{總質量}{體積}$,總質量一定,體積一定,故密度一定,故混合氣體的密質不再發生改變不能說明達到平衡狀態,故B錯誤;
C.因為平衡常數僅與溫度有關,當平衡常數不再變化,即反應的溫度不變,又在絕熱恒容的容器中,所以反應的平衡常數不再變化能說明達到平衡狀態,故C正確;
D.在恒溫恒壓的容器中,NO的體積分數保持不變,則反應達平衡,能說明達到平衡狀態,故D正確;
故選CD,
故答案為:CD;
(4)根據圖象分析,常壓下NO的轉化率已經較高,并且高壓轉化率增加不大,但增加成本較大,
故答案為:常壓下NO的轉化率已經較高,并且高壓要增加成本;
(5)①溫度一定,隨反應物NO、CO的起始物質的量比增大,X-Y反應正向進行,一氧化碳的轉化率X<Y,Y-Z平衡正向進行,一氧化氮增大會提高一氧化碳的轉化率,則Y<Z,X、Y、Z三點,CO的轉化率的從大到小的順序Z>Y>X,
故答案為:Z>Y>X;
②根據圖象1分析,溫度越低NO的平衡轉化率越大,說明該反應為放熱反應,所以溫度越低,平衡時二氧化碳的體積分數也越大,又T2<T1,所以溫度為T2時的變化趨勢曲線為: ,
,
故答案為: ;
;
點評 本題考查了蓋斯定律計算,化學反應速率、平衡常數概念理解和計算應用,圖象分析方法,反應自發進行的判斷依據是關鍵,題目難度中等.


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 苯酚鈉溶液中通少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 向Ca(ClO)2溶液中通入過量SO2:Ca2++2ClO-+SO2+H2O═CaSO4↓+2H++Cl-+HClO | |
| C. | 用新制的氫氧化銅懸濁液檢驗乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 在碳酸氫鈣溶液中加入過量的氫氧化鈣溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2,H2S,SO2 | B. | N2,Cl2,HBr | C. | CO2,O2,NO | D. | NH3,CO2,HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E為原子序數依次增大的五種短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物種類最多,C元素的氫化物是最常用的溶劑,D元素在同周期元素中離子半徑最小.請回答:
A、B、C、D、E為原子序數依次增大的五種短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物種類最多,C元素的氫化物是最常用的溶劑,D元素在同周期元素中離子半徑最小.請回答: ;D元素的最高價氧化物的水化物的電離方程式Al(OH)3?Al3++3OH-.
;D元素的最高價氧化物的水化物的電離方程式Al(OH)3?Al3++3OH-.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
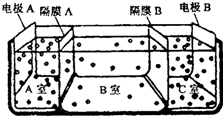
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 正極反應為:Zn-2e-═Zn2+ | |
| B. | 電池反應為:Zn+Cu2+═Zn2++Cu | |
| C. | 在外電路中,電子從銅電極流向鋅電極 | |
| D. | 鹽橋中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
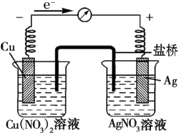 某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.
某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com