
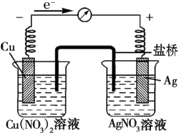
 某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.
某探究小組將反應Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag (s)設計成原電池,某時刻的電子流向及電流表(A)指針偏轉方向如圖所示.分析 (1)Cu失電子作負極,發生氧化反應生成銅離子;
(2)電解質溶液中陽離子向正極移動,陰離子向負極移動,取出鹽橋后不能形成閉合回路;
(3)Cu(NO3)2溶液中Cu電極失電子生成銅離子;
(4)根據電極方程式結合轉移電子守恒計算分析.
解答 解:(1)Cu失電子作負極,發生氧化反應生成銅離子,負極的電極方程式為Cu-2e-=Cu2+;
故答案為:Cu;Cu-2e-=Cu2+;
(2)電解質溶液中陽離子向正極移動,所以鹽橋中K+向正極移動,陰離子向負極移動,則NO3+向負極移動;取出鹽橋后不能形成閉合回路,不能構成原電池,所以電流表的指針將不再發生偏轉;
故答案為:正;負;不再發生偏轉;
(3)Cu(NO3)2溶液中Cu電極失電子生成銅離子,所以Cu(NO3)2溶液中c(Cu2+)將增大;故答案為:增大;
(4)已知正極:2Ag++2e-=2Ag,負極:Cu-2e-=Cu2+,電路中轉移電子的物質的量為0.5mol,則正極質量增加0.5mol×108g/mol=54g,負極質量減少$\frac{1}{2}$×0.5mol×64g/mol=16,所以兩極質量差為54+16=70g;
故答案為:70.
點評 本題考查學生原電池的工作原理以及電極反應和電子轉移之間的關系知識,注意把握原電池的構成條件、電極方程式的書寫等基礎知識的積累,題目難度不大.


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注.CO2和H2在一定條件下反應生成甲醇(CH3OH)等產生,工業上利用該反應合成甲醇.
人類活動產生的CO2長期積累,威脅到生態環境,其減排問題受到全世界關注.CO2和H2在一定條件下反應生成甲醇(CH3OH)等產生,工業上利用該反應合成甲醇.| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 按如圖所示裝置進行實驗,并回答下列問題:
按如圖所示裝置進行實驗,并回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
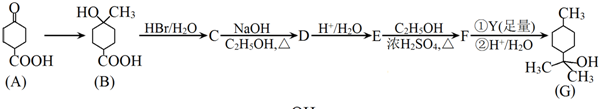
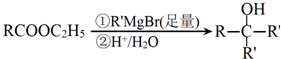
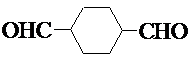 .
.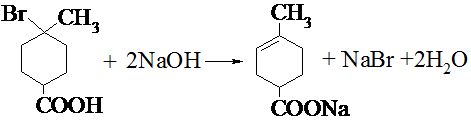 .
.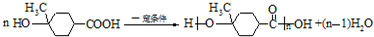 .
.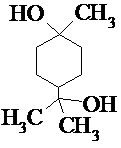 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有脫水性 | |
| B. | 濃硝酸在光照下顏色變黃,說明濃硝酸不穩定 | |
| C. | 常溫下,濃硝酸可以用鋁罐貯存,說明鋁與濃硝酸不反應 | |
| D. | 向碘水中滴加CCl4,振蕩靜置后分層,CCl4層呈紫紅色,說明可用CCl4從碘水中萃取碘 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
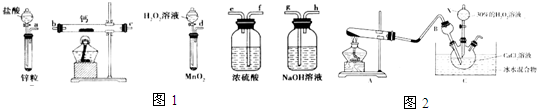
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
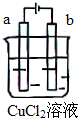
| A. | 電極a表面呈紅色 | |
| B. | 電極b表面有氣泡生成 | |
| C. | 電子由電源的負極沿導線流向電極b | |
| D. | 該裝置能量轉化形式為化學能轉化為電能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com