
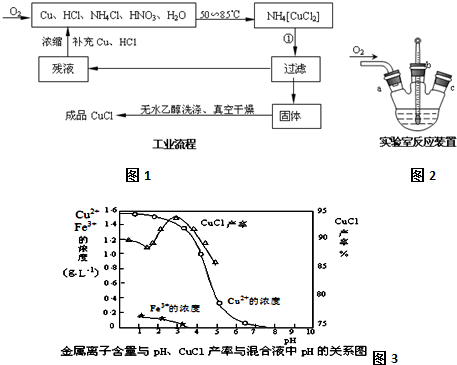
分析 (1)依據流程分析NH4[CuCl2]分解產物過濾后得到濾液為氯化銨,固體為CuCl;
(2)由題給信息可知CuCl微溶于水,不溶于乙醇,在空氣中會被迅速氧化;
(3)依據乙醇沸點低利用蒸餾方法回收利用,制備過程中的氯化銨和硝酸直接利用;
(4)制備氯化亞銅所用的原料中含有氯化銨溶解過程中吸熱,生成的紅棕色氣體二氧化氮污染氣體不能排放,需要通入氧氣至恰好吸收生成硝酸循環使用;
(5)在硫酸銅溶液中加入氯化鈉、鐵,發生氧化還原反應生成CuCl;由圖可知,析出CuCl沉淀的最佳pH應為CuCl的產率最大,且氫氧化鐵雜質較少.
解答 解:(1)NH4[CuCl2]分解產物過濾后得到濾液為氯化銨,固體為CuCl,反應的化學方程式為NH4[CuCl2]=CuCl↓+NH4Cl,
故答案為:NH4[CuCl2]=CuCl↓+NH4Cl;
(2)由題給信息可知CuCl微溶于水,不溶于乙醇,在空氣中會被迅速氧化,為防止氧化應隔絕空氣,在干燥、真空環境中可加快乙醇和水的蒸發,
故答案為:加快乙醇和水的蒸發,防止CuCl被空氣氧化;
(3)根據乙醇的沸點較低,可以利用蒸餾的方法回收乙醇循環利用,反應過程中的氯化銨和硝酸可以在混合液中 直接利用,
故答案為:蒸餾;HNO3;
(4)制備氯化亞銅所用的原料為Cu、HCl、NH4Cl、HNO3、H2O,其中含有氯化銨溶解過程中吸熱,反應過程中生成的紅棕色氣體二氧化氮污染氣體不能排放,需要通入氧氣至恰好吸收生成硝酸循環使用,4NO2+O2+2H2O=4HNO3,
故答案為:氯化銨溶于水吸收大量熱量,造成反應液溫度降低;燒瓶上方紅棕色氣體逐漸變為無色;
(5)在硫酸銅溶液中加入氯化鈉、鐵,發生氧化還原反應生成CuCl,發生2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;由圖可知,析出CuCl沉淀的最佳pH應為CuCl的產率最大,且氫氧化鐵雜質較少,應約為3左右,故答案為:2Cu2++2Cl-+Fe=2CuCl↓+Fe2+;3.
點評 本題考查了物質制備的流程分析和反應產物判斷,為高頻考點,側重于學生的分析能力和實驗能力的考查,注意把握反應條件、反映實際的選擇,反應過程中物質循環利用的綠色化學思想,題目難度中等.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 提高CO2充氣壓力,飲料中c(A-)不變 | |
| B. | 當pH為5.0時,飲料中 $\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| C. | 相比于未充CO2的飲料,碳酸飲料的抑菌能力較低 | |
| D. | 結合H+的能力:A->HCO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com