
分析 (1)硫粉難溶于水、微溶于乙醇,乙醇濕潤可以使硫粉易于分散到溶液中;
(2)由于S2O32?具有還原性,易被氧氣氧化成硫酸根離子可知雜質為硫酸鈉;硫代酸酸鈉和鹽酸反應生成氯化鈉、二氧化硫、單質硫和水;
(3)生成的碘單質遇到淀粉變藍,用硫代硫酸鈉滴定時,當藍色褪去半分鐘不變化,說明反應達到終點;溶液中發生的反應為:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,根據方程式列出各物質的關系為2Ba2+~2BaCrO4~Cr2O72-~3 I2~6S2O32-和2BaCrO4~Cr2O72-~3I2~3SO32-計算.
解答 解:(1)硫粉難溶于水微溶于乙醇,所以硫粉在反應前用乙醇濕潤是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接觸,加快反應速率
故答案為:有利于硫粉和Na2SO3溶液充分接觸,加快反應速率;
(2)S2O32?具有還原性,能夠被氧氣氧化成硫酸根離子,所以可能存在的雜質是硫酸鈉,
故答案為:Na2SO4;
(3)依據標定的原理可知,生成的碘單質遇到淀粉變藍,用硫代硫酸鈉滴定當藍色褪去半分鐘不變化,說明反應達到終點;溶液中發生的反應為:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,
n(Na2S2O3)=0.0360 L×0.100 mol•L-1=0.0036 mol
則n(Na2SO3)=0.00360 mol÷5=0.00072 mol
根據題意:2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-
2 6
n1 0.0036 mol
得n1(Ba2+)=$\frac{0.0036mol×2}{6}$=0.0012 mol
2Ba2+~2BaCrO4~Cr2O72-~3I2~3SO32-
2 3
n2 0.00072mol
得得n2(Ba2+)=$\frac{0.00072mol×2}{3}$=0.00048 mol
則c(Ba2+)=$\frac{0.0012mol+0.00048mol}{0.05L}$=3.36×10-2 mol•L-1,
故答案為:淀粉;藍色褪去半分鐘不變化;3.36×10-2 mol•L-1.
點評 本題綜合考查物質的制備以及含量的測定,為高考常見題型,側重于學生的分析能力、實驗能力和計算能力的考查,注意把握實驗的原理,結合反應的關系式計算,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | K+、NH4+、Fe3+、Ba2+ |
| 陰離子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
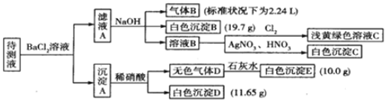
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| 陽離子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 陰離子 | OH- Cl- CO32- SO42- HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
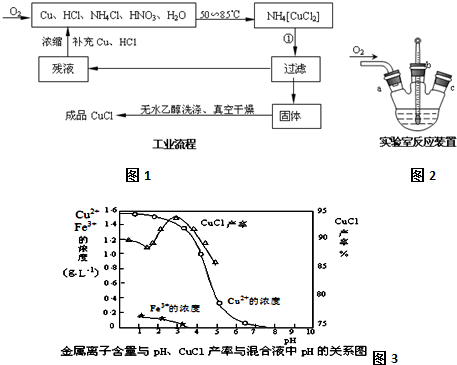
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若D與鹽酸反應,可生成A和B,則X一定是H2O | |
| B. | 若D為NaCl,且A可與C反應生成B,則E 可能是CO2 | |
| C. | 若D是一種強堿,則A、B、C均可與X反應生成D | |
| D. | 若D是一種強酸,則A既可以是單質,也可以是化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合氣通過盛酸性高錳酸鉀溶液的洗氣瓶 | |
| B. | 混合氣通過盛足量溴水的洗氣瓶 | |
| C. | 混合氣通過盛水的洗氣瓶 | |
| D. | 混合氣跟氯化氫混合 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com