
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
分析 A.鎂離子與偏鋁酸根離子發生雙水解反應;
B.鋁離子與碳酸氫根離子發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體;
C.四種離子之間不發生反應,能夠共存;
D.鈣離子、氫離子及酸性條件下的硝酸根離子都能夠與S2O32-反應.
解答 解:A.Mg2+、AlO2-之間發生雙水解反應,在溶液中不能大量共存,故A錯誤;
B.Al3+、HCO3-之間發生雙水解反應,在溶液中不能大量共存,故B錯誤;
C.NH4+、Fe3+、SO42-、NO3-之間不反應,在溶液中能夠大量共存,故C正確;
D.H+、NO3-、S2O32-之間發生氧化還原反應,Ca2+、H+都與S2O32-反應,在溶液中不能共存,故D錯誤;
故選C.
點評 本題考查離子共存的判斷,題目難度中等,注意掌握離子反應發生條件,明確離子不能大量共存的一般情況:能發生復分解反應的離子之間;能發生氧化還原反應的離子之間;能發生絡合反應的離子之間(如 Fe3+和 SCN-)等;試題側重對學生基礎知識的訓練和檢驗,有利于提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.2gCH3OH含有的化學鍵數為0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3膠體中膠粒數是0.1NA | |
| C. | 標準狀況下,2.24LCl2溶于足量水,轉移的電子數為0.1NA | |
| D. | 0.2gD216O中含有的質子數、中子數和電子數均為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3和NaHCO3粉末與同濃度的鹽酸時,Na2CO3因為堿性強,所以與鹽酸反應放出氣體速度快 | |
| B. | 等物質的量的兩種鹽與同濃度的鹽酸反應,Na2CO3所消耗鹽酸的體積是 NaHCO3的兩倍 | |
| C. | 向Na2CO3飽和溶液中通人過量CO2,有NaHCO3結晶析出 | |
| D. | Na2CO3和NaHCO3溶液分別和BaCl2溶液反應,現象不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 如圖為A物質的溶解度曲線.M、N兩點分別表示A物質的兩種溶液.下列做法不能實現M、N間的相互轉化的是(A從溶液中析出時不帶結晶水,步驟中的過濾操作均未寫出)( )
如圖為A物質的溶解度曲線.M、N兩點分別表示A物質的兩種溶液.下列做法不能實現M、N間的相互轉化的是(A從溶液中析出時不帶結晶水,步驟中的過濾操作均未寫出)( )| A. | 從N→M:先向N中加入適量固體A再降溫 | |
| B. | 從N→M:先將N降溫再加入適量固體A | |
| C. | 從M→N:先將M降溫再將其升溫 | |
| D. | 從M→N:先將M升溫再將其蒸發掉部分水 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
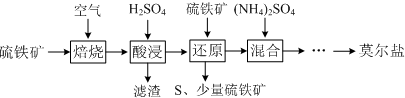
| 離子 | 離子濃度(mol•L-1) | |
| 還原前 | 還原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 原子半徑:r(W)>r(Z)>r(Y) | |
| B. | 含Y元素的鹽溶液一定顯酸性 | |
| C. | 最高價氧化物對應水化物的酸性:Z>W | |
| D. | X、W分別形成的簡單氣態氫化物可反應生成離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
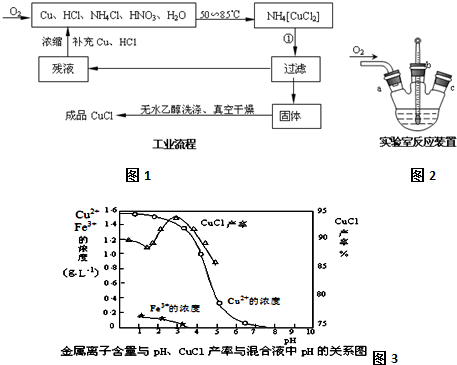
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com