
| A. | 若容器內壓強不再變化,則說明該反應己達平衡 | |
| B. | 反應前H2S物質的量為2.5mol | |
| C. | CO和H2S達平衡后的轉化率相同 | |
| D. | 若平衡后再加入CO,則正反應速率增大,逆反應速率減小 |
分析 A.反應前后氣體體積不變,反應過程中和平衡狀態下壓強始終不變;
B.反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,轉化的CO為2mol,設反應前H2S物質的量為nmol,表示出平衡時各物質的物質的量,由于反應前后氣體物質的量不變,用物質的量代替濃度代入平衡常數K=$\frac{c(COS)c({H}_{2})}{c(CO)c({H}_{2}S)}$=0.1列方程計算解答;
C.依據B計算分析CO、H2S的轉化率;
D.通入CO后瞬間正反應速率增大、逆反應速率不變,平衡正向移動,正反應速率減小、逆反應速率增大到新平衡時相等;
解答 解:A.CO (g)+H2S (g)?COS (g)+H2 (g),反應前后氣體體積不變,反應過程中和平衡狀態下壓強始終不變,容器內壓強不再變化,不能說明該反應己達平衡,故A錯誤;
B.反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,轉化的CO為2mol,設反應前H2S物質的量為nmol,則:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
變化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
由于反應前后氣體物質的量不變,用物質的量代替濃度計算平衡常數,則K=$\frac{c(COS)c({H}_{2})}{c(CO)c({H}_{2}S)}$=$\frac{2×2}{8×(n-2)}$=1,解得n=2.5,故B正確;
C.CO和H2S的起始量不同,反應消耗量相同,轉化率一定不同,故C錯誤;
D.通入CO后瞬間正反應速率增大、逆反應速率不變,平衡正向移動,正反應速率減小、逆反應速率增大到新平衡時相等,故通入CO后重新達平衡,正、逆反應速率均增大,故D錯誤;
故選B.
點評 本題考查化學平衡計算、化學平衡建立,難度中等,注意三段式在化學平衡計算中應用,掌握基礎是關鍵.


 名校提分一卷通系列答案
名校提分一卷通系列答案 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案 新卷王期末沖刺100分系列答案
新卷王期末沖刺100分系列答案 全能闖關100分系列答案
全能闖關100分系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子數目相等的三種氣體,質量最大的是Z | |
| B. | 相同條件下,同質量的三種氣體,氣體密度最小的是X | |
| C. | 若一定條件下,三種氣體體積均為2.24L,則它們的物質的量一定均為0.1mol | |
| D. | 同溫下,體積相同的兩容器分別充2gY氣體和1gZ氣體,則其壓強比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 壓強(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的濃度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
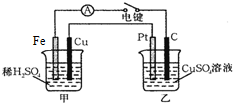 原電池和電解池都能實現能量的置換.回答下列問題:
原電池和電解池都能實現能量的置換.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇和乙醚互為同分異構體 | |
| B. | 干餾煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 乙醇和乙酸之間能發生酯化反應,酯化反應和皂化反應互為逆反應 | |
| D. | 在酸性條件下,蔗糖水解的化學方程式為 C12H22O11+H2O→2C6H12O6(葡萄糖) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 氣體W為氧氣 | |
| B. | b極與電源的正極相連 | |
| C. | 離子交換膜c為陽離子交換膜 | |
| D. | a極的電極反應為SO2+2H2O-2e-=SO42-+4H+. |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com