
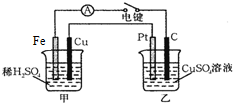
 原電池和電解池都能實現能量的置換.回答下列問題:
原電池和電解池都能實現能量的置換.回答下列問題:分析 (1)能自發的發生氧化還原反應,能構成原電池,原電池中化學能轉化為電能;
(2)能自發的發生氧化還原反應能設計成原電池;
(3)FeCl3溶液與Cu反應生成氯化亞鐵和氯化銅;
(4)甲中Fe為負極,Cu為正極,Pt電極為陽極,陽極上氫氧根離子失電子生成氧氣;甲中Cu電極上氫離子得電子生成氫氣,乙中C上銅離子得電子生成Cu,根據電子守恒計算.
解答 解:(1)能自發的發生氧化還原反應,能構成原電池,原電池中化學能轉化為電能,甲中Fe、Cu和稀硫酸構成原電池,即甲池可將化學能轉化為電能;
故答案為:甲;
(2)能自發的發生氧化還原反應能設計成原電池,
①2FeCl3+Fe═3FeCl2屬于能自發的發生氧化還原反應,能設計成原電池,故正確;
②AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,屬于復分解反應,不是氧化還原反應,不能設計成原電池,故錯誤;
③NaOH+HCl═NaC1+H2O,屬于復分解反應,不是氧化還原反應,不能設計成原電池,故錯誤;
故答案為:①;
(3)FeCl3溶液與Cu反應生成氯化亞鐵和氯化銅,其反應的離子方程式為:2Fe3++Cu=Cu2++2Fe2+;
故答案為:2Fe3++Cu=Cu2++2Fe2+;
(4)甲中Fe為負極,Cu為正極,Pt電極為陽極,陽極上氫氧根離子失電子生成氧氣,其電極方程式為:2H2O-4e-=O2↑+4H+;
甲中Cu電極上氫離子得電子生成氫氣,電極方程式為:2H++2e-=H2↑,產生0.1mol氣體時,轉移電子為0.2mol,乙中C上銅離子得電子生成Cu,其電極反應為Cu2++2e-=Cu,轉移0.2mol電子時生成0.1molCu,所以Cu的質量為64g/mol×0.1mol=6.4g;
故答案為:2H2O-4e-=O2↑+4H+;6.4.
點評 本題考查了原電池原理和電解原理的應用,明確正負極、陰陽極上放電的物質或離子是解本題關鍵,注意電子守恒在計算中的應用,題目難度中等,側重于考查學生的分析能力和對基礎知識的綜合應用能力.


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:解答題
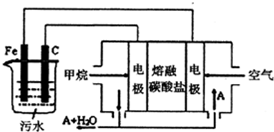 電浮選凝聚法是工業上采用的一種污水處理方法,通過電解污水最終生成的Fe(OH)3吸附污物而沉積下來,達到凈水的目的.陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,除去浮渣層,即起到了浮選凈化的作用,某科研小組利用上述原理,設計出如圖所示的裝置.
電浮選凝聚法是工業上采用的一種污水處理方法,通過電解污水最終生成的Fe(OH)3吸附污物而沉積下來,達到凈水的目的.陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,除去浮渣層,即起到了浮選凈化的作用,某科研小組利用上述原理,設計出如圖所示的裝置.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 結論 |
| A | 向KI溶液中加入CCl4,振蕩后靜置 | 液體分層,下層呈紫紅色 | 碘易溶于CCl4,難溶于水 |
| B | 向Fe(NO3)2樣品溶于稀H2SO4 | 溶液不變紅 | 稀硫酸不能氧化Fe2+ |
| C | 將SO2通入Ba(N03)2溶液中 | 無明顯現象 | SO2與Ba(NO3)2不反應 |
| D | 葡萄糖溶液與新制Cu(OH)2混合加熱 | 生成磚紅色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若容器內壓強不再變化,則說明該反應己達平衡 | |
| B. | 反應前H2S物質的量為2.5mol | |
| C. | CO和H2S達平衡后的轉化率相同 | |
| D. | 若平衡后再加入CO,則正反應速率增大,逆反應速率減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol | B. | 2 mol | C. | 7 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 合金貯氫材料具有優異的吸收氫性能,在配合氫能的開發中起到重要作用.
合金貯氫材料具有優異的吸收氫性能,在配合氫能的開發中起到重要作用.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高體系溫度,平衡常數K減小 | |
| B. | 增大體系壓強,平衡常數K不發生變化 | |
| C. | 平衡常數表達式為K=$\frac{[CO][{H}_{2}]}{[C][{H}_{2}O]}$ | |
| D. | 增加C(s)的量,平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧燃料電池是一種將化學能轉化為電能的裝置 | |
| B. | 鐵船舶的外殼上鑲嵌鋅塊,可避免船體遭受腐蝕 | |
| C. | 鋼鐵腐蝕時負極的電極反應式:Fe-3e-═Fe+ | |
| D. | 工業上電解飽和食鹽水時陰極的電極反應式:2H++2e-═H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com