
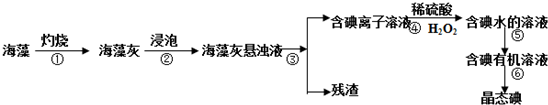
分析 Ⅰ.海帶灼燒可生成水和二氧化碳,海帶灰中含有碘化鉀等物質,溶于水,浸泡過濾得到含有碘離子的溶液,加入氯水或通入氯氣,氯氣置換出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有機溶液,經蒸餾可得到碘,以此解答該題,
(1)步驟③用于分離固體和液體,步驟⑤是從溶液中提取碘,利用萃取分液;
(2)步驟④對應反應是過氧化氫與碘離子發(fā)生氧化還原反應生成碘;
(3)萃取的基本原則兩種溶劑互不相溶,且溶質在一種溶劑中的溶解度比在另一種大的多;
Ⅱ.海水提溴原理:先將濃縮海水中的Br-用氯氣氧化;再將溴吹入吸收塔,使溴蒸汽和二氧化硫吸收劑發(fā)生作用轉變成氫溴酸得到富集溴;用氯氣將富集的溴負離子氧化得到產品溴.
Ⅲ.(1)工業(yè)中冶煉鋁的反應是電解熔融的氧化鋁生成率和氧氣;
(2)Fe2O3與Al粉混合物發(fā)生鋁熱反應,實質是置換反應,生成鐵和氧化鋁,引發(fā)鋁熱反應是用鋁熱劑的上面加少量KClO3,中間插上鎂條并將其點燃,由此分析解答;
(3)鋁和氫氧化鈉反應生成偏鋁酸鈉和氫氣,根據氫氣的量可知鋁的質量;
解答 解:Ⅰ.海帶灼燒可生成水和二氧化碳,海帶灰中含有碘化鉀等物質,溶于水,浸泡過濾得到含有碘離子的溶液,加入氯水或通入氯氣,氯氣置換出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有機溶液,經蒸餾可得到碘,
(1)步驟③用于分離固體和液體,為過濾操作,步驟⑤從溶液中提取碘,為萃取操作,故答案為:過濾;萃取;
(2)步驟④對應反應是過氧化氫與碘離子發(fā)生氧化還原反應生成碘,反應的離子方程式為:H2O2+2H++2I-═I2+2H2O,
故答案為:H2O2+2H++2I-═I2+2H2O;
(3)萃取的基本原則兩種溶劑互不相溶,且溶質在一種溶劑中的溶解度比在另一種大的多,故可用四氯化碳、苯等,
故答案為:C;
Ⅱ.將溴吹入吸收塔,使溴蒸汽和二氧化硫吸收劑發(fā)生作用轉變成氫溴酸得到富集溴離子方程式為Br2+SO2+2H2O=4H++SO42-+2Br-,故答案為:Br2+SO2+2H2O=4H++SO42-+2Br-;
Ⅲ.(1)在工業(yè)中冶煉鋁的反應方程式為:2Al2O3$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑,
故答案為:2Al2O3$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑;
(2)Fe2O3與Al粉混合物發(fā)生鋁熱反應,實質是置換反應,生成鐵和氧化鋁,方程式為:2Al+Fe2O3═2Fe+Al2O3,引發(fā)鋁熱反應的實驗操作是在鋁熱劑的上面加少量KClO3,中間插上鎂條并將其點燃,故答案為:在鋁熱劑的上面加少量KClO3,中間插上鎂條并將其點燃;2Al+Fe2O3═2Fe+Al2O3;
(3)鋁和氫氧化鈉反應生成偏鋁酸鈉和氫氣,反應的方程式為:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,由方程式可知n(Al)=0.1mol,m(Al)=0.1mol×27g/mol=2.7g,
故答案為:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;2.7.
點評 本題考查了海水資源的利用和提純、萃取分液的實驗基本操作、鋁及其性質和應用,掌握基礎是解題關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 中和pH和體積都相同的鹽酸和醋酸,消耗NaOH的物質的量之比為1:1 | |
| C. | pH=3的鹽酸和pH=3的FeCl3溶液中,由水電離出的c(H+)相等 | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用惰性電極電解NaH2PO2溶液,其陽極反應式為2H2O-4e-=O2↑+4H+ | |
| B. | 將H3PO2溶液加入到酸性重鉻酸鉀溶液中,H3PO2的還原產物可能為H3PO4 | |
| C. | H3PO2溶于水的電離方程式為H3PO2?H++H3PO2- | |
| D. | H3PO2與過量NaOH溶液反應的離子方程式為H3PO2+3OH-=PO23-+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | TiO2是氧化劑 | |
| B. | 四氯化鈦是還原產物 | |
| C. | Cl2發(fā)生氧化反應 | |
| D. | 氧化劑與還原劑的物質的量之比為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器內氣體壓強不再改變 | |
| B. | N2和H2的物質的量不變且比例為1:3 | |
| C. | 斷裂1mol N≡N鍵的同時,斷裂3 mol H-H鍵 | |
| D. | 反應消耗N2、H2與產生NH3的速率之比1:3:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
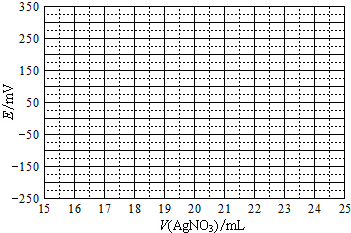
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉻元素在周期表中處于第四周期V IB族 | |
| B. | 鉻原子的外圍電子層排布為3d44s2 | |
| C. | 鉻原子中,質子數為24 | |
| D. | 鉻元素位于元素周期表的d區(qū),是過渡元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com