
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
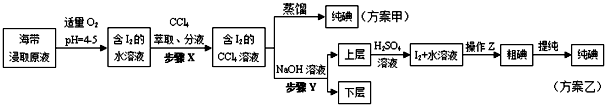
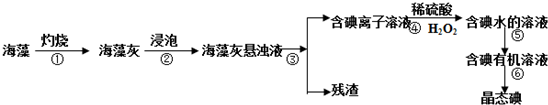
分析 (1)在儀器A中灼燒海帶,該儀器為坩堝;配制溶液體積為500mL,應該選用規格為500mL的容量瓶;
(2)①根據表中數據繪制出滴定曲線;
②根據圖象判斷滴定終點時用去AgNO3溶液的體積;根據硝酸銀與碘離子的反應計算出100mL溶液中含有碘離子的物質的量,再計算出500mL溶液中含有的碘離子,最后計算出海帶中碘的百分含量;
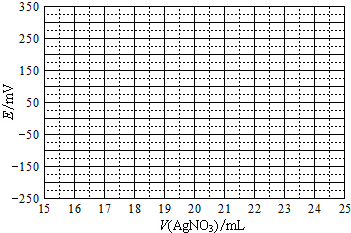
(3)①檢查分液漏斗是否漏水,需要分別檢查瓶塞、旋塞是否漏水;
②碘單質易溶于有機溶劑,且四氯化碳溶液密度大于水溶液,檢查判斷萃取現象;
③A.反應3I2+6NaOH═5NaI+NaIO3+3H2O中,需要濃氫氧化鈉溶液;
B.碘單質與氫氧化鈉反應生成了碘化鈉、碘酸鈉;
C.該操作的主要目的是將碘單質轉化成碘酸鈉、碘化鈉,便于后續分離出碘單質;
D.乙醇易溶于水和四氯化碳,仍然無法分離出碘單質.
④碘單質不溶于水,可以通過過濾操作分離出碘單質;
(4)從碘單質易升華角度分析.
解答 解:(1)根據儀器的構造可知,用于灼燒海帶的儀器為坩堝;通過儀器B配制500mL含有碘離子的浸取液,需要使用500mL的容量瓶,
故答案為:坩堝;500mL容量瓶;
(2)①根據表中數據可以繪制出電動勢(E)與消耗硝酸銀溶液體積的關系圖為: ,
,
故答案為: ;
;
②根據滴定曲線可知,當加入20mL硝酸銀溶液時,電動勢出現了突變,說明滴定終點時消耗了20.00mL硝酸銀溶液;
20.00mL硝酸銀溶液中含有硝酸銀的物質的量為:0.0100mol/L×0.02L=0.0002mol,則500mL原浸出液完全反應消耗硝酸銀的物質的量為:0.0002mol×$\frac{500ml}{100ml}$=0.001mol,說明20.00g該海帶中含有0.001mol碘離子,所以海帶中碘的百分含量為:$\frac{127g/mol×0.001mol}{20.00g}$×100%=0.635%,
故答案為:20.00mL;0.635;
(3)①檢查分液漏斗是否漏水的操作方法為:向分液漏斗中加入少量蒸餾水,檢查旋塞處是否漏水;將漏斗倒轉過來,檢查玻璃塞是否漏水,
故答案為:向分液漏斗中加入少量蒸餾水,檢查旋塞處是否漏水,將漏斗倒轉過來,檢查玻璃塞是否漏水;
②碘單質易溶于有機溶劑,微溶于水,且四氯化碳的密度大于水溶液,所以步驟X向含有碘單質的水溶液中加入四氯化碳后,混合液會分為上下兩層,下層為四氯化碳的碘溶液,則下層呈紫紅色,
故答案為:液體分為上下兩層,下層呈紫紅色;
③A.發生反應3I2+6NaOH═5NaI+NaIO3+3H2O中,需要濃氫氧化鈉溶液,所以應控制NaOH溶液的濃度和體積,故A正確;
B.根據反應3I2+6NaOH═5NaI+NaIO3+3H2O可知,步驟Y將碘轉化成離子進入水層,故B正確;
C.該操作的主要目的是將碘單質轉化成碘酸鈉、碘化鈉,將碘轉化成離子進入水層,不是除去有機雜質,故C錯誤;
D.乙醇易溶于水和四氯化碳,將氫氧化鈉換成乙醇,仍然無法分離出碘單質,故D錯誤;
故答案為:AB;
④步驟Z將碘單質和水分離,由于碘單質不溶于水,可通過過濾操作完成,故答案為:過濾;
(4)方案甲中采用蒸餾操作,由于碘單質容易升華,會導致碘單質損失,所以甲方案不合理,
故答案為:碘單質易升華,會導致碘損失.
點評 本題考查物質的分離與提純方法的綜合應用,題目難度中等,試題涉及的知識點較多、綜合性較強,充分考查學生的分析、理解能力及化學實驗能力,明確實驗原理為解答關鍵,注意熟練掌握化學實驗基本操作方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
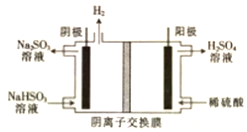 電解原理在工業生產中應用廣泛.
電解原理在工業生產中應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3+SiO2$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑ | B. | CO+H2O$\stackrel{高溫}{?}$CO2+H2 | ||
| C. | CO2+2NaOH═Na2CO3+H2O | D. | CO+2H2$\stackrel{一定條件}{→}$CH3OH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

 ;A的最高價氧化物對應水化物的化學式為HNO3.
;A的最高價氧化物對應水化物的化學式為HNO3.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com