
分析 (1)加入碎瓷片可防止液體暴沸;
(2)乙酸與乙醇在濃硫酸作用下加熱發生酯化反應生成乙酸乙酯和水,該反應為可逆反應,增加乙醇的量平衡正向移動,提高乙酸的轉化率;
(3)減小生產物的濃度的方法,平衡正向移動,可以提高酯的產率;
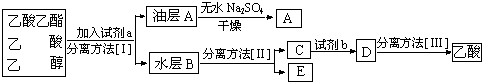
(4)分離粗產品乙酸乙酯、乙酸和乙醇的混合物,加入飽和碳酸鈉溶液,乙酸乙酯不溶于飽和碳酸鈉,采用分液的方法即可,水層中的乙酸鈉要用硫酸反應得到乙酸,再蒸餾得到乙酸;
(5)①根據甲得到了顯酸性的酯的混合物,說明加入的氫氧化鈉溶液不足進行分析;
②根據乙酸乙酯能夠與氫氧化鈉溶液發生水解分析失敗原因.
解答 解:(1)乙酸和乙醇的沸點較低,加熱,加入碎瓷片可防止液體暴沸,故答案為:碎瓷片;防止燒瓶中液體暴沸;
(2)乙酸與乙醇在濃硫酸作用下加熱發生酯化反應生成乙酸乙酯和水,該反應為可逆反應,增加乙醇的量平衡正向移動,提高乙酸的轉化率,故答案為:提高乙酸的轉化率;
(3)減小生產物的濃度的方法,平衡正向移動,可以提高酯的產率,故答案為:及時地蒸出生成物,有利于酯化反應向生成酯的方向進行;
(4)分離粗產品乙酸乙酯、乙酸和乙醇的混合物,加入飽和碳酸鈉溶液,實現酯與乙酸和乙醇的分離,分離油層和水層采用分液的方法即可.對水層中的乙酸鈉和乙醇進一步分離時應采取蒸餾操作分離出乙醇.然后水層中的乙酸鈉要用硫酸反應得到乙酸,再蒸餾得到乙酸,
故答案為:a:飽和Na2CO3溶液;I:分液;II:蒸餾;b:硫酸;III:蒸餾;
(5)①甲得到顯酸性的酯的混合物,酸有剩余,說明是所加NaOH溶液不足未將酸完全反應,故答案為:所加NaOH溶液不足未將酸完全反應;
②乙得到大量水溶性物質,說明沒有酯,是因為所加NaOH溶液過量,酯發生水解,故答案為:所加NaOH溶液過量,酯發生水解.
點評 本題考查了常見物質的分離與提純方法,題目難度中等,注意明確物質分離與提純常用的方法,熟悉分液操作與蒸餾操作各適用于分離的混合物類型及正確操作方法.


科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ⑥⑦ | C. | ④⑥⑦ | D. | ⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 植物油是高分子化合物,不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最終產物是葡萄糖 | |
| C. | 葡萄糖能發生氧化反應和水解反應 | |
| D. | 蛋白質溶液遇硫酸銅后發生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
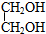 ,寫出有關反應的化學方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.
,寫出有關反應的化學方程式.CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O;CH2=CH2+Cl2→CH2Cl-CH2Cl;CH2Cl-CH2Cl+2NaOH $→_{△}^{水}$HOCH2CH2OH+2NaCl.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CH3COOCH2CH3+H2O,該反應類型為酯化反應(取代反應).
CH3COOCH2CH3+H2O,該反應類型為酯化反應(取代反應).查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上月考一化學試卷(解析版) 題型:填空題
硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
(1)如果2min內SO2的 濃度由6mol/L下降為2mol/L,那么,用O2濃度變化來表示的反應速率為 .
濃度由6mol/L下降為2mol/L,那么,用O2濃度變化來表示的反應速率為 .
(2)某溫度下,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖1所示.根據圖示回答下列問題:
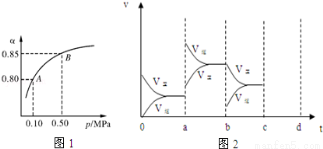
平衡狀態由A變到B時平衡常數K(A) K(B)(填“>”、“<”或“=”).
(3)此反應在恒溫密閉的裝置中進行,能充分說明此反應已達到平衡的標志是 (填字母).
A.接觸室中氣體的平均相對分子質量不再改變
B.接觸室中SO2、O2、SO3的濃度相同
C.接觸室中SO2、SO3的物質的量之比為2:1:2
D.接觸室中壓強不隨時間變化而變化
(4)圖2表示該反應在密閉容器中達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況,a~ b過程中改變的條件可能是 ;b~c過程中改變的條件可能是 ; 若增大壓強時,請把反應速率變化情況畫在c~d處.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com