
| A. | ①② | B. | ⑥⑦ | C. | ④⑥⑦ | D. | ⑥ |
分析 ①構造原理揭示的電子排布能級順序,實質是各能級能量高低順序,原子軌道充滿或半充滿時原子的能量處于最低狀態不遵循構造原理;
②電負性是元素的原子在化合物中吸引電子能力的標度,電負性可以判斷元素的金屬性和非金屬性;第一電離能I1是指氣態原子X(g)處于基態時,失去一個電子成為氣態陽離子X+(g)所需的能量;
③分子中鍵能越大,能量越低,分子越穩定;
④含有配位鍵的化合物是配合物;
⑤所有含極性鍵的分子不一定是極性分子,可能是非極性分子;
⑥熔融狀態下能導電的化合物中一定含有自由移動的離子,所以一定是離子化合物;
⑦原子晶體中半導體導電.
解答 解:①原子的電子排布遵循構造原理能使整個原子的能量處于最低狀態,但軌道充滿或半充滿時,能量較小,如Cu:3d104s1,Cr:3d54s1,不遵循構造原理,故錯誤;
②同周期從左到右,元素的非金屬性依次增強,元素的第一電離能越來越大,雖電負性依次增強,但稀有氣體除外,故錯誤;
③鍵能越大、能量越低的分子越穩定,所以分子中鍵能越大,分子越穩定,表示分子擁有的能量越低,故錯誤;
④含配位鍵的不一定是配合物,如銨根離子不是絡離子,氯化銨不是配合物而是離子化合物,故錯誤;
⑤所有含極性鍵的分子不一定是極性分子,可能是非極性分子,如甲烷、二氧化碳等只含極性鍵但是非極性分子,故錯誤;
⑥熔融狀態下能導電的化合物中一定含有自由移動的離子,含有離子鍵,所以一定是離子化合物,故正確;
⑦原子晶體中半導體導電,如Si等,故錯誤;
故選D.
點評 本題考查物質結構性質,涉及分子極性判斷、離子化合物的判斷、元素周期律、配合物等知識點,綜合性較強,把握基本概念及元素周期律即可解答,注意第一電離能的變化規律及異常現象,為易錯點.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S | B. | O2 | C. | SO2 | D. | SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 2種 | B. | 3種 | C. | 4種 | D. | 5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
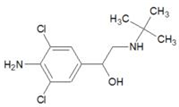 2011年3 月17日《京華時報》報道,雙匯集團就“瘦肉精”事件致謙,涉事子公司停產整頓.鹽酸克倫特羅(clenbuteerol CLB),俗名“瘦肉精”. 其結構如圖所示,下列有關“瘦肉精”的說法中正確的是( )
2011年3 月17日《京華時報》報道,雙匯集團就“瘦肉精”事件致謙,涉事子公司停產整頓.鹽酸克倫特羅(clenbuteerol CLB),俗名“瘦肉精”. 其結構如圖所示,下列有關“瘦肉精”的說法中正確的是( )| A. | 該分子是極性分子 | |
| B. | 該分子中有兩個手性碳 | |
| C. | 分子中C、N、O的第一電離能的大小順序為:C<N<O | |
| D. | 苯環上的一溴代物只有一種結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
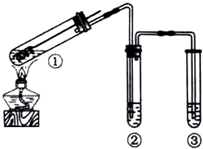
| A. | 為確認CuSO4生成,向①中加水,觀察顏色 | |
| B. | 上下移動①中銅絲可控制SO2的量 | |
| C. | ②中選用品紅溶液驗證SO2的生成 | |
| D. | ③中選用NaOH溶液吸收多余的SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
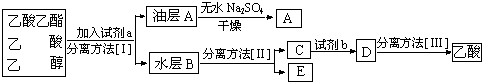
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com