
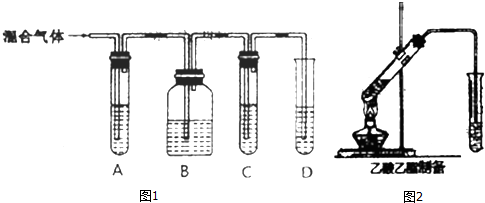
 CH3COOCH2CH3+H2O,該反應類型為酯化反應(取代反應).
CH3COOCH2CH3+H2O,該反應類型為酯化反應(取代反應). 分析 Ⅰ.(1)二氧化硫是否存在可用品紅溶液檢驗,檢驗乙烯可以用溴水或高錳酸鉀酸性溶液;乙烯和二氧化硫都能使溴水或高錳酸鉀酸性溶液褪色;但乙烯不與NaOH溶液反應,二氧化硫能與堿反應(SO2+2NaOH=Na2SO3+H2O),故乙烯的檢驗應放在排除SO2的干擾后進行,先通過品紅溶液褪色檢驗SO2的存在;再通過NaOH溶液除去SO2,再通過品紅溶液不褪色確認SO2已除干凈,最后用溴水褪色實驗檢驗乙烯;
(2)根據(1)的分析,最后用溴水褪色實驗檢驗乙烯,乙烯分子含有不飽和碳碳雙鍵,能和溴單質發生加成反應;
Ⅱ.在乙醇的催化氧化中,金屬銅作催化劑,銅參與反應,最后會生成金屬銅;
Ⅲ.(1)根據吸收乙酸乙酯用飽和碳酸鈉溶液,乙酸乙酯不溶于水溶液分析,濃硫酸做酯化反應的催化劑和吸水劑;
(2)裝置中發生的反應是醋酸和乙醇在濃硫酸催化作用下發生酯化反應,生成乙酸乙酯和水.
解答 解:Ⅰ.(1)乙烯不與NaOH溶液反應,但二氧化硫能與堿反應(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品紅溶液檢驗.乙烯的檢驗應放在排除SO2的干擾后進行,選通過品紅溶液褪色檢驗SO2的存在;再通過NaOH溶液除去SO2,再通過品紅溶液不褪色確認SO2已除干凈.最后用溴水褪色實驗檢驗乙烯,
故答案為:④;①;④;②;
(2)根據以上分析,裝置D中是用溴水來檢驗乙烯,溴水溶液褪色,說明含有乙烯,反應的方程式是CH2=CH2+Br2→CH2Br-CH2Br,
故答案為:溴水褪色;CH2=CH2+Br2→CH2Br-CH2Br;
Ⅱ.當銅絲置于外焰加熱時發現銅絲變黑,2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,銅網由黑色變成紅色是由于乙醇和氧化銅反應生成銅,反應的方程式為CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,
乙醇催化氧化,生成乙醛和水,總反應方程式為:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案為:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
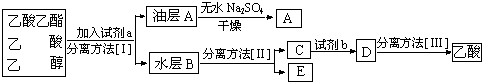
Ⅲ.(1)吸收乙酸乙酯用飽和碳酸鈉溶液,所以右試管中通常加入飽和碳酸鈉溶液;又乙酸乙酯不溶于水溶液,所以分離的方法為分液,所用的儀器是分液漏斗;濃硫酸有吸水性,促進該反應向正反應方向移動,濃硫酸能加快反應速率,所以濃硫酸作催化劑;
故答案為:飽和碳酸鈉;分液漏斗;催化劑、吸水劑;
(2)裝置中發生的反應是醋酸和乙醇在濃硫酸催化作用下發生酯化反應,生成乙酸乙酯和水,反應的化學方程式為:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,酯化反應屬于取代反應,
CH3COOCH2CH3+H2O,酯化反應屬于取代反應,
故答案為:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;酯化反應(取代反應).
CH3COOCH2CH3+H2O;酯化反應(取代反應).
點評 本題考查乙烯的化學性質、制備、常見氣體的檢驗以及乙酸乙酯的制備,題目難度中等,注意實驗的先后順序,學習中注重實驗評價能力的培養.


科目:高中化學 來源: 題型:選擇題
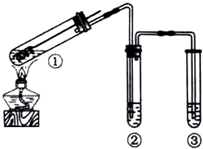
| A. | 為確認CuSO4生成,向①中加水,觀察顏色 | |
| B. | 上下移動①中銅絲可控制SO2的量 | |
| C. | ②中選用品紅溶液驗證SO2的生成 | |
| D. | ③中選用NaOH溶液吸收多余的SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Te>Cl>S | B. | 熱穩定性:H2Te>H2S>PH3 | ||
| C. | 還原性:Cl->S2->Te2- | D. | 酸性:HClO4>H2SO4>H2TeO4 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上10月月考化學試卷(解析版) 題型:選擇題
一定條件下反應2AB(g) 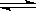 A2(g)+B2(g)達到平衡狀態的標志是( )
A2(g)+B2(g)達到平衡狀態的標志是( )
A.單位時間內生成 nmolA2的同時消耗n molAB
nmolA2的同時消耗n molAB
B.容器內,3種氣體AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各組分的體積分數不隨時間變化
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上月考一化學卷(解析版) 題型:選擇題
反應CO(g)+2H2(g) 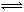 CH3OH(g)過程中的能量變化情況如下圖所示,曲線Ⅰ和曲線Ⅱ分別表示不使用催化劑和使用催化劑的兩種情況。下列判斷正確的是
CH3OH(g)過程中的能量變化情況如下圖所示,曲線Ⅰ和曲線Ⅱ分別表示不使用催化劑和使用催化劑的兩種情況。下列判斷正確的是
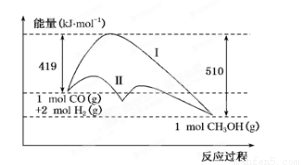
A.該反應的ΔH=+91 kJ/mol B.加入催化劑,該反應的ΔH變小
C.反應物的總能量大于生成物的總能量 D.如果該反應生成液態CH3OH,則ΔH變大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com