
| A. | 鹽酸與碳酸鋇反應 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸銅溶液中滴加氫氧化鋇溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸銀溶液中加入銅粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 鐵與稀鹽酸反應 2Fe+6H+═2Fe3++3H2↑ |
分析 A.碳酸鋇為難溶物,離子方程式中不能拆開;
B.硫酸銅與氫氧化鋇溶液反應生成硫酸鋇和氫氧化銅沉淀;
C.離子方程式兩邊正電荷不相等,違反了電荷守恒;
D.反應生成的應該是亞鐵離子.
解答 解:A.碳酸鋇不能拆開,正確的離子方程式為:BaCO3+2H+=Ba2++H2O+CO2↑,故A錯誤;
B.硫酸銅溶液中滴加氫氧化鋇溶液,反應的離子方程式為:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓,故B正確;
C.硝酸銀溶液中加入銅粉,二者發生置換反應,正確的離子方程式為:2Ag++Cu═Cu2++2Ag↓,故C錯誤;
D.鐵與稀鹽酸反應生成氯化亞鐵和氫氣,正確的離子方程式為:Fe+2H+═Fe2++H2↑,故D錯誤;
故選B.
點評 本題考查了離子方程式的正誤判斷,為高考的高頻題,屬于中等難度的試題,注意明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)等.


 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案 浙大優學小學年級銜接導與練浙江大學出版社系列答案
浙大優學小學年級銜接導與練浙江大學出版社系列答案 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 摩爾既是物質的數量單位又是物質的質量單位 | |
| B. | 阿伏加德羅常數是 12kg12C中含有的碳原子數 | |
| C. | 1molH2O中含有2mol H和1mol O | |
| D. | 一個NO分子的質量是ag,一個NO2分子的質量是bg,則氧原子的摩爾質量是(b-a)g/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
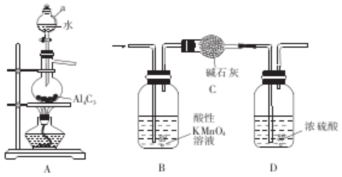
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
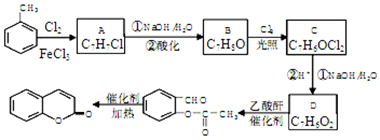
 ,A→B的反應類型是取代反應.
,A→B的反應類型是取代反應.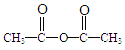 )反應,除生成
)反應,除生成 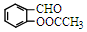 外,同時生成的另一種產物的結構簡式是CH3COOH.
外,同時生成的另一種產物的結構簡式是CH3COOH.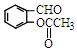 互為同分異構體,且具有以下特點:
互為同分異構體,且具有以下特點:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X氣體 | Y溶液 | 預測的現象 | 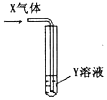 | |
| ① | CO2 | 飽和Na2CO3溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
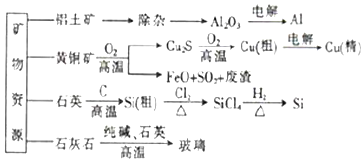
| A. | 制取玻璃和粗硅的同時均產生CO2氣體 | |
| B. | 生產高純硅、鋁、銅及玻璃的過程中都涉及氧化還原反應 | |
| C. | 粗硅制高純硅時,提純四氯化硅可用過濾的方法(SiCl4的熔點-70℃,沸點57.7℃) | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用作冶煉鐵的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2在反應中被還原 | |
| B. | NaClO3在反應中失去電子 | |
| C. | H2SO4在反應中作氧化劑 | |
| D. | 1 mol氧化劑在反應中得到1 mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com