
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.分析 (1)Pb2O3中+3價的Pb具有強氧化性,能氧化濃鹽酸,+3價的Pb被濃鹽酸還原成+2價,確定生成物PbC12、C12、H2O,再配平可得化學方程式;
(2)根據題意,確定反應物為PbO2,寫出方程式,再利用方程式進行計算求解;
(3)根據氧化還原反應的本質電子得失守恒求出n(O2)、n(Cl2),即得y與x的函數關系;
(4)根據兩步反應中O2和Cl2的物質的量之比為3:5,求出x的值,確定出n(pb2+):n(pb4+)的比值,再設法求解即可;
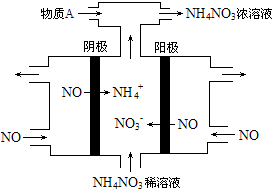
(5)電解NO制備NH4NO3,由圖可知乙為陽極反應為NO-3e-+2H2O=NO3-+4H+,甲為陰極反應為:NO+5e-+6H+=NH4++H2O,從兩極反應可看出,要使得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,總反應方程式為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3,因此若要使電解產物全部轉化為NH4NO3,需補充NH3,根據電子守恒計算.
解答 解:(1)Pb2O3中Pb的化合價只有+3,且+3價的Pb具有氧化性,能氧化濃鹽酸生成C12,本身被還原成+2價Pb,生成PbC12,根據元素守恒得反應物與生成物并根據化合價升降法配平該氧化還原反應,得出Pb2O3+6HCl(濃)═2PbCl2+Cl2↑+3H2O,
故答案為:Pb2O3+6HCl(濃)═2PbCl2+Cl2↑+3H2O;
(2)根據題意:1mol PbO2分解所得混合物中n(Pb2+)=x mol、n(Pb4+)=(1-x) mol.在反應過程中1mol PbO2中+4價的Pb具有強氧化性作氧化劑,
+4價的Pb最終全部降低為+2價,根據得失電子守恒:先加熱分解生成O2,得n(O2)=$\frac{2x}{4}$a=$\frac{x}{2}$amol;
后再與足量的濃鹽酸反應生成Cl2,得n(Cl2)=a×$\frac{(1-x)×2}{2}$=(1-x)a mol,
故答案為:$\frac{ax}{2}$mol;a(1-x)mol;
(3)y=n(O2)+n(Cl2)=$\frac{x}{2}$mol+(1-x)a mol=(1-$\frac{x}{2}$)amol,故答案為:y=(1-$\frac{x}{2}$)amol;
(4)若兩步反應中O2和Cl2的物質的量之比為5:3,根據上述分析:n(O2)=a×$\frac{x}{2}$=mol,n(Cl2)=a(1-x)mol,即 $\frac{x}{2}$:(1-x)=5:3,解得:x=$\frac{10}{13}$,則剩余固體中含pb2+的物質的量分數為$\frac{10}{13}$,含pb4+的物質的量分數為 $\frac{3}{13}$,即n(pb2+):n(pb4+)=10:3,
由題意,PbO2不穩定逐步分解順序:PbO2→Pb2O3→Pb3O4→PbO.因為Pb的化合價只有+2、+4,所以Pb2O3可表示為PbO•PbO2,Pb3O4可表示為2PbO•PbO2,各氧化物中n(pb2+):n(pb4+)的比值關系為:
PbO2中,n(pb2+):n(pb4+)=0:1
Pb2O3中,n(pb2+):n(pb4+)=1:1
Pb3O4中,n(pb2+):n(pb4+)=2:1
PbO中,n(pb2+):n(pb4+)=1:0,
根據剩余固體中n(pb2+):n(pb4+)=10:3,介于3:1和4:1之間,所以此時剩余固體包括Pb3O4、PbO兩種物質,
設剩余固體中Pb3O4物質的量為a、PbO物質的量為b,
得n(pb2+)=2a+b,n(pb4+)=a,
則(2a+b):a=10:3
解得a:b=3:4,即Pb3O4:PbO=3:4,
故答案為:Pb3O4、PbO;3:4;
(5)電解NO制備NH4NO3,由圖可知乙為陽極反應為NO-3e-+2H2O=NO3-+4H+,甲為陰極反應為:NO+5e-+6H+=NH4++H2O,從兩極反應可看出,要使得失電子守恒,陽極產生的NO3-的物質的量大于陰極產生的NH4+的物質的量,總反應方程式為:8NO+7H2O$\frac{\underline{\;通電\;}}{\;}$3NH4NO3+2HNO3,因此若要使電解產物全部轉化為NH4NO3,需補充NH3;
由電子守恒可知:5NH4NO3~~~15e-~~~$\frac{15}{2}$Pb
5×80 $\frac{15}{2}$×207
1000kg xkg
解得x=$\frac{\frac{15}{2}×207×1000kg}{5×80}$=3881kg;
故答案為:NH3;根據總反應式:8NO+7H2O$\frac{\underline{\;通電\;}}{\;}$4NH4NO3+2HNO3,電解產生的HNO3多;3881.
點評 本題考查氧化還原反應知識、電解原理的應用,利用化合價升降法配平,抓住本質電子的得失守恒是解題的關鍵,同時結合中間值確定反應產物.題目難度中等,側重于考查學生對基礎知識的綜合應用能力和分析能力.


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性學習小組設計了一組實驗,驗證元素周期律.
某研究性學習小組設計了一組實驗,驗證元素周期律.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 錫中加入一定量的鉛制成焊錫,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、藥品包裝的材料 | |
| C. | 大量燃燒化石燃料是造成霧霾天氣的一種重要因素 | |
| D. | 含重金屬離子的電鍍廢液不能隨意排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
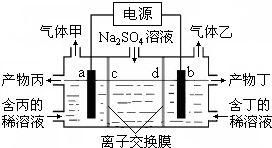 工業上常用電解硫酸鈉溶液聯合生產硫酸和燒堿,生產裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法中正確的是( )
工業上常用電解硫酸鈉溶液聯合生產硫酸和燒堿,生產裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法中正確的是( )| A. | a極與電源的負極相連 | B. | 產物丙為硫酸溶液 | ||
| C. | 離子交換膜d為陰離子交換膜 | D. | b電極反應式:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液時,下層液體從分液漏斗下口放出,上層液體從上口倒出 | |
| B. | 在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有脫水性 | |
| C. | 蒸餾操作時,使用的冷凝水應該由低往高流,形成逆流 | |
| D. | 蒸發操作時,應使混合物中的水分子蒸干后,才能停止加熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用分液漏斗分離乙醇和水的混合液體 | |
| B. | 用硝酸洗滌做過銀鏡反應的試管 | |
| C. | 分餾石油時,溫度計的末端必須插入液面下 | |
| D. | 配制新制Cu(OH)2溶液時,在2mL10% CuSO4溶液中滴入幾滴2%NaOH溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com