
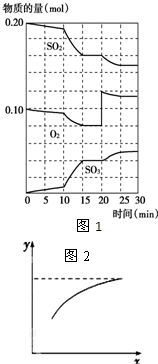
 硫酸生產中,接觸室內的反應為:
硫酸生產中,接觸室內的反應為:
| ||
| △ |
| X | y | |
| A | 再加入SO2 | O2的轉化率 |
| B | 再加入SO3 | SO2的體積分數 |
| C | 壓強 | 混合氣體的物質的量 |
| D | 溫度 | 混合氣體的平均摩爾質量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反應放出或 吸收的熱量(kJ) | a | b | c | d |
| 平衡時c(SO3)(mol/L) | e | f | g | h |
| △c |
| △t |
| 2mol-1.6mol |
| 2mol |
| △c |
| △t |
| 0.4mol |
| 1L |
| 1.6mol |
| 1L |
| 0.8mol |
| 1L |
| 0.8×1.62 |
| 0.42 |
| 1.8 |
| 2 |
| 0.2mol |
| 0.9mol |
| 2 |
| 9 |
| 2 |
| 9 |


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| A、0.21 mol?L-1 |
| B、0.56 mol?L-1 |
| C、0.24 mol?L-1 |
| D、0.12 mol?L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 (1)按要求寫出下列反應方程式:
(1)按要求寫出下列反應方程式: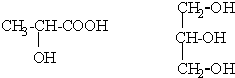
查看答案和解析>>
科目:高中化學 來源: 題型:
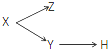
| X | Y | Z | H | |
| A | 分散系 | 膠體 | 溶液 | 煙 |
| B | 電解質 | 酸 | 堿 | 鹽 |
| C | 元素周期表的縱列 | 主族 | 副族 | 鹵族 |
| D | 化合物 | 共價化合物 | 離子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化學 來源: 題型:
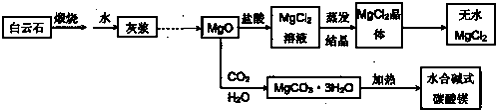
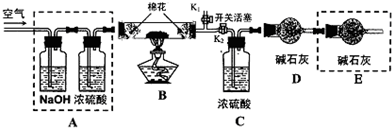
查看答案和解析>>
科目:高中化學 來源: 題型:
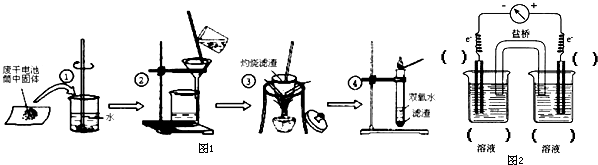
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
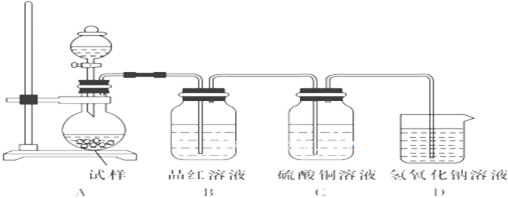
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com