
| 編號 | 熱化學方程式 | 化學平衡常數 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |

分析 (1)由蓋斯定律可得,總反應3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)為方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3;
化學平衡常數K=K12•K2•K3;
(2)要提高CH3OCH3產率,應該改變條件使平衡正向移動;
(3)新工藝中反應③消耗反應②中的產物H2O,減小生成物的濃度,有利于平衡向正反應方向移動;
(3)勒夏特列原理:如果改變可逆反應的條件(如濃度、壓強、溫度等),化學平衡就被破壞,并向減弱這種改變的方向移動;
(4)A.升高溫度CO轉化率降低,說明平衡逆向移動,升高溫度平衡向吸熱方向移動;
B.增大壓強平衡正向移動,則CO轉化率增大,根據圖知,壓強P1>P2>P3,增大壓強CO轉化率增大;
C.當反應物的物質的量之比等于其計量數之比時,反應物的轉化率相等;
D.若在p3和316℃時,起始時$\frac{n({H}_{2})}{n(CO)}$=3,則達平衡時CO的轉化率增大;
(5)可用體積分數求出各物質的濃度,然后再利用平衡常數的公式求出平衡常數,相同條件下,氣體的體積分數等于其物質的量分數,設參加反應的n(CO)=xmol,
該反應中 4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),
開始(mol)8.0 4.0 0 0
反應(mol)2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物質的量分數=$\frac{0.5x}{8.0-2x+4.0-x+0.5x+0.5x}$×100%=25%,
x=3
則平衡時c(H2)=$\frac{8.0-6.0}{2}$=1mol/L、c(CO)=$\frac{4-3}{2}$=0.5mol/L、c(CH3OCH3)=$\frac{1.5}{2}$mol/L=0.75mol/L、c(H2O)=$\frac{1.5}{2}$mol/L=0.75mol/L,化學平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{4}({H}_{2}){c}^{2}(CO)}$.
解答 解:(1)由蓋斯定律可得,總反應3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)為方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ•mol-1;總反應的平衡常數等于分反應的平衡常數之積,則K=K12•K2•K3.
故答案為:-263 kJ•mol-1;K12•K2•K3;
(2)A.分離出二甲醚,使平衡正向移動,所以能提高二甲醚的產率,故正確;
B.升高溫度,平衡逆向移動,降低二甲醚的產率,故錯誤;
C.改用高效催化劑只能改變化學反應速率,不影響平衡移動,不改變二甲醚產率,故錯誤;
D.增大壓強平衡正向移動,提高二甲醚產率,故正確;
故答案為:AD;
(3)(4)反應③消耗了反應②中的產物H2O,使反應②的化學平衡向正反應方向移動,從而提高CH3OCH3的產率,
故答案為:反應③消耗了反應②中的產物H2O,使反應②的化學平衡向正反應方向移動,從而提高CH3OCH3的產率;
(4)A.升高溫度CO轉化率降低,說明平衡逆向移動,升高溫度平衡向吸熱方向移動,則該反應△H<0,故A錯誤;
B.增大壓強平衡正向移動,則CO轉化率增大,根據圖知,壓強P1>P2>P3,增大壓強CO轉化率增大,CO轉化率應該大于50%,故B錯誤;
C.當反應物的物質的量之比等于其計量數之比時,反應物的轉化率相等,所以若在p3和316℃時反應達到平衡,H2的轉化率等于50%,故C正確;
D.若在p3和316℃時,起始時$\frac{n({H}_{2})}{n(CO)}$=3,則達平衡時CO的轉化率增大,所以CO轉化率大于50%,故D正確;
故答案為:CD;
(5)相同條件下,氣體的體積分數等于其物質的量分數,設參加反應的n(CO)=xmol,
該反應中 4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),
開始(mol)8.0 4.0 0 0
反應(mol)2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物質的量分數=$\frac{0.5x}{8.0-2x+4.0-x+0.5x+0.5x}$×100%=25%,
x=3
則平衡時c(H2)=$\frac{8.0-6.0}{2}$=1mol/L、c(CO)=$\frac{4-3}{2}$=0.5mol/L、c(CH3OCH3)=$\frac{1.5}{2}$mol/L=0.75mol/L、c(H2O)=$\frac{1.5}{2}$mol/L=0.75mol/L,化學平衡常數K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{4}({H}_{2}){c}^{2}(CO)}$=$\frac{0.75×0.75}{0.{5}^{2}×{1}^{4}}$=2.25,
故答案為:2.25.
點評 本題考查化學平衡計算、蓋斯定律、化學平衡移動影響因素等知識點,側重考查學生分析、判斷及計算能力,明確溫度、壓強對化學平衡移動影響及三段式方法在化學平衡計算中的靈活應用是解本題關鍵,題目難度中等.


科目:高中化學 來源: 題型:推斷題
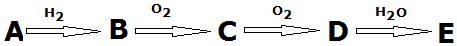
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
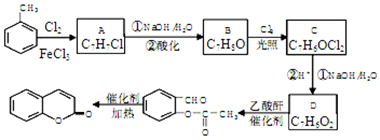
 ,A→B的反應類型是取代反應.
,A→B的反應類型是取代反應.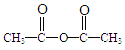 )反應,除生成
)反應,除生成 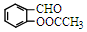 外,同時生成的另一種產物的結構簡式是CH3COOH.
外,同時生成的另一種產物的結構簡式是CH3COOH.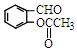 互為同分異構體,且具有以下特點:
互為同分異構體,且具有以下特點:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
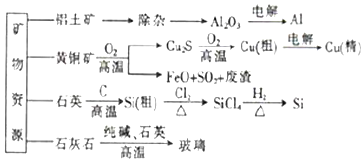
| A. | 制取玻璃和粗硅的同時均產生CO2氣體 | |
| B. | 生產高純硅、鋁、銅及玻璃的過程中都涉及氧化還原反應 | |
| C. | 粗硅制高純硅時,提純四氯化硅可用過濾的方法(SiCl4的熔點-70℃,沸點57.7℃) | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用作冶煉鐵的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2在反應中被還原 | |
| B. | NaClO3在反應中失去電子 | |
| C. | H2SO4在反應中作氧化劑 | |
| D. | 1 mol氧化劑在反應中得到1 mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在KClO3+6HCl=3Cl2↑+KCl+3H2O中,被氧化的氯原子和被還原的氯原子的個數比為6:1 | |
| B. | 在反應:2KNO3+3C+S=K2S+N2↑+3CO2↑,則被還原的元素為氮和硫 | |
| C. | 失電子能力難的原子獲得電子的能力一定強 | |
| D. | 在化學反應中某元素由化合態變為游離態,該元素一定被還原了 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.3 mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com