
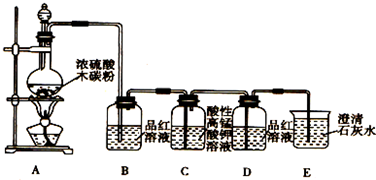
分析 (1)碳和濃硫酸在加熱條件下反應生成SO2和CO2、水.
(2)SO2具有漂白性,可以使品紅溶液褪色,因此常用品紅溶液檢驗SO2;
(3)酸性高錳酸鉀具有強氧化性,可以氧化二氧化硫,SO2和CO2均能使澄清石灰水變渾濁,因此在用澄清石灰水檢驗CO2之前必須把SO2吸收干凈;
(4)裝置D中品紅溶液不褪色,說明SO2除干凈;
(5)裝置E中澄清的石灰水變渾濁,說明產物中一定存在CO2氣體,CO2和氫氧化鈣反應生成碳酸鈣沉淀.
解答 解:(1)碳和濃硫酸在加熱條件下反應生成SO2和CO2、水,其反應方程式為:C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案為:C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)SO2具有漂白性,可以使品紅溶液褪色,常用品紅溶液檢驗SO2,因此裝置B中品紅溶液用于檢驗產物SO2,
故答案為:品紅褪色;SO2;漂白性;
(3)酸性高錳酸鉀具有強氧化性,可以氧化二氧化硫,因此用酸性高錳酸鉀溶液吸收SO2,表現了二氧化硫的還原性,SO2和CO2均能使澄清石灰水變渾濁,因此在用澄清石灰水檢驗CO2之前必須把SO2吸收干凈,
故答案為:還原性;甲;
(4)SO2具有漂白性,可以使品紅溶液褪色,裝置D中品紅溶液不褪色,說明SO2除干凈,
故答案為:已除盡;
(5)裝置E中澄清的石灰水變渾濁,說明產物中一定存在CO2氣體,CO2和氫氧化鈣反應生成碳酸鈣沉淀,化學方程式為:CO2+Ca(OH)2=CaCO3↓+H2O,
故答案為:澄清石灰水變渾濁; CO2;CO2+Ca(OH)2=CaCO3↓+H2O.
點評 本題考查了濃硫酸的強氧化性、SO2和CO2性質的比較,注意SO2和CO2均能使澄清石灰水變渾濁,因此在用澄清石灰水檢驗CO2之前必須把SO2吸收干凈,有利于培養學生的良好的科學素養,提高學生學習實驗的積極性,難度中等.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:解答題
 1905年德國化學家哈伯發明了合成氨的方法,他因此獲得了1918年度諾貝爾化學獎.氨的合成不僅解決了地球上因糧食不足而導致的饑餓與死亡問題,在國防、能源、輕工業方面也有廣泛用途.
1905年德國化學家哈伯發明了合成氨的方法,他因此獲得了1918年度諾貝爾化學獎.氨的合成不僅解決了地球上因糧食不足而導致的饑餓與死亡問題,在國防、能源、輕工業方面也有廣泛用途.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
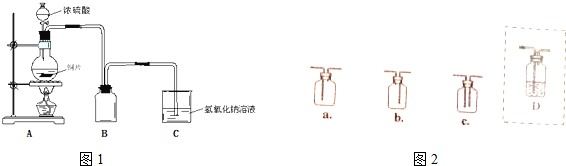
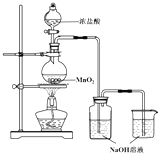 某實驗小組用如圖裝置制備家用消毒液,并探究其性質.反應停止后,取洗氣瓶中無色溶液5mL分別進行了如下實驗:
某實驗小組用如圖裝置制備家用消毒液,并探究其性質.反應停止后,取洗氣瓶中無色溶液5mL分別進行了如下實驗:| 操作 | 現象 |
| a.測溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液變紅,5min后褪色 |
| b.向其中逐滴加入鹽酸 | 溶液逐漸變成黃綠色 |
| 操作 | 現象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液變紅,30min后褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com