
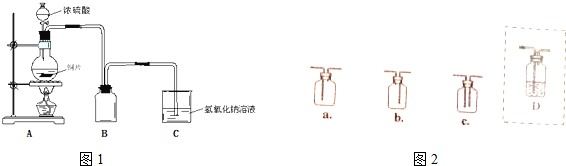
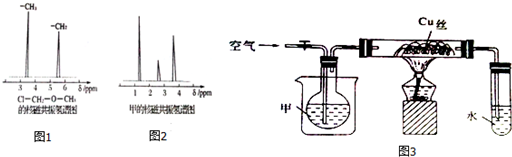
分析 (1)銅和濃硫酸加熱一生成二氧化硫氣體,二氧化硫比空氣重,用向上排氣法收集,進氣的導氣管長進短處;
(2)①銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水;
②通過證明反應后的溶液中存在氫離子,可以證明硫酸有剩余;
③金屬銅只能和濃硫酸之間反應,但是不會和稀硫酸之間反應;
(3)二氧化硫能使品紅褪色,能使溴水褪色,能使酸性高錳酸鉀褪色,據此回答.
解答 解:(1)銅和濃硫酸加熱一生成二氧化硫氣體,二氧化硫比空氣重,用向上排氣法收集,進氣的導氣管長進短處,圖中補進氣管伸入近集氣瓶底,裝置圖為:a,
故答案為:a;
(2)①銅和濃硫酸加熱反應生成硫酸銅、二氧化硫和水,反應的化學方程式為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②能證明反應停止后燒瓶中有硫酸剩余,只要證明氫離子的存在即可,當不能依據溶液中存在硫酸根離子而證明濃硫酸有剩余,
A.硫酸鈉溶液不與氫離子反應,無法證明硫酸有剩余,故A錯誤;
B.氯化鋇溶液能證明硫酸根離子存在,但不能證明氫離子存在,故B錯誤;
C.銀粉和稀硫酸不反應,則不能證明氫離子的存在,故C錯誤;
D.碳酸鈉溶液和氫離子反應生成二氧化碳氣體,有氣體生成可以證明反應后的溶液中存在氫離子,從而證明明溶液中存在稀硫酸,故D正確;
故答案為:D;
③金屬銅只能和濃硫酸之間反應,但是不會和稀硫酸之間反應,隨著反應的進行,濃硫酸會變稀,故答案為:銅不會和稀硫酸之間反應;
(3)二氧化硫能使品紅褪色,能使溴水褪色,能使酸性高錳酸鉀褪色,為檢驗二氧化硫,可以用品紅、溴水、酸性高錳酸鉀等物質檢驗,故答案為:品紅(溴水、酸性高錳酸鉀).
點評 本題通過濃硫酸的性質考查了性質實驗方案的設計與評價,題目難度中等,試題知識點較多、綜合性較強,充分考查了學生的想、理解能力,注意熟練掌握濃硫酸與銅的反應原理,明確性質實驗方案的設計及評價原則.


 小天才課時作業系列答案
小天才課時作業系列答案 一課四練系列答案
一課四練系列答案 黃岡小狀元滿分沖刺微測驗系列答案
黃岡小狀元滿分沖刺微測驗系列答案 新輔教導學系列答案
新輔教導學系列答案 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 古人利用明礬溶液的酸性來清洗青銅器上的銅銹 | |
| B. | 人體攝入適量的油脂有利于促進維生素的吸收 | |
| C. | 《肘后備急方》中記載“青蒿一握,以水二升漬,絞取汁”,所述過程不涉及化學變化 | |
| D. | 手機外殼上貼的碳纖維外膜是一種新型的有機高分子材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
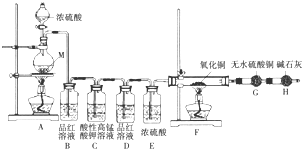
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
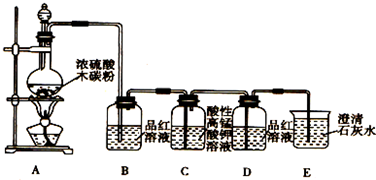
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
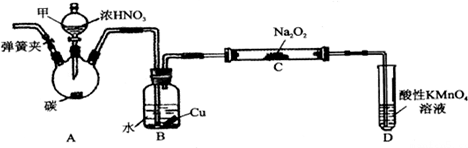
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com