
分析 (1)SO2被Na2SO3溶液吸收生成亞硫酸氫鈉;
(2)根據Ka越大酸性越強,根據酸性較強的能與酸性較弱的酸根離子反應;
(3)根據電離和水解程度的相對大小分析;既電離又水解,以電離為主,溶液顯酸性;
(4)+4價的硫元素能被氧氣氧化為+6價;
(5)根據過量NaHSO3溶液的還原性和I2的氧化性能繼續發生氧化還原反應來分析反應產物.
解答 解:(1)SO2被Na2SO3溶液吸收生成亞硫酸氫鈉,離子反應為SO32-+SO2+H2O=2HSO3-,
故答案為:SO32-+SO2+H2O=2HSO3-;
(2)已知Ka越大酸性越強,酸性較強的能與酸性較弱的酸根離子反應,由于HCO3-的酸性小于HSO3-的酸性,所以HCO3-與SO32-不反應,即bc能共存,
故答案為:bc;
(3)HSO3 -在溶液中電離出氫離子,同時HSO3 -能水解,由于電離程度大于水解程度,所以溶液顯酸性;HSO3 -既電離又水解,以電離為主,溶液顯酸性,則溶液中的離子濃度大小關系為:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案為:亞硫酸氫根的電離程度大于水解程度;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(4)+4價的硫元素能被氧氣氧化為+6價,則亞硫酸氫鈉溶液放置在空氣中一段時間,會被空氣中的氧氣氧化,其反應的離子方程式為:2HSO3-+O2=2SO42-+2H+,
故答案為:2HSO3-+O2=2SO42-+2H+;
(5)NaIO3溶液中滴加過量NaHSO3溶液時,I2能與NaHSO3發生氧化還原反應,碘元素的化合價降低,則還原產物為NaI,
故答案為:NaI;
點評 本題考查了寒流物質的性質,反應離子方程式書寫、鹽類水解應用、電解質溶液中離子濃度大小比較、氧化還原反應等知識點,掌握基礎是解題關鍵,題目難度中等.


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加A的量,平衡正向移動,達到新平衡時K值增大 | |
| B. | 升高溫度,K值增大 | |
| C. | K越大,說明該反應的進行程度越大 | |
| D. | 該反應的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將飽和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3膠體 | |
| B. | 膠體區別于其它分散系的本質特征是膠體粒子的直徑大小 | |
| C. | 用過濾的方法可以分離和提純膠體 | |
| D. | 煮雞蛋的過程中發生了膠體的電泳現象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
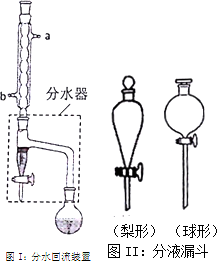 實驗室制備乙酸正丁酯的化學方程式:
實驗室制備乙酸正丁酯的化學方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸點(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com