
分析 2min末已生成2mol W,則v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反應速率之比等于化學計量數之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
轉化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
以此解答該題.
解答 解:2min末已生成2mol W,則v(W)=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol/l/(L•min),反應速率之比等于化學計量數之比即n:2=v(z):v(w)=0.5:0.5,n=2,
2X(g)+Y (g)?2 Z (g)+2W (g)
起始(mol) 8 4 0 0
轉化(mol) 2 1 2 2
平衡(mol) 6 3 2 2
(1)前2min內v(X)=v(Z)0.5mol•(L•min)-1,
答:前2min內用X的濃度變化表示的平均反應速率為0.5 mol/(L•min);
(2)2min末時Y的濃度為$\frac{3mol}{2L}$=1.5mol/L,
答:2min末時Y的濃度為1.5 mol/L;
(3)由以上分析可知化學反應方程式中n值為2,
故答案為:化學反應方程式中n值為2.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法計算、速率、濃度的計算方法為解答的關鍵,側重分析與計算能力的考查,題目難度不大.


 導學全程練創優訓練系列答案
導學全程練創優訓練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 增加A的量,平衡正向移動,達到新平衡時K值增大 | |
| B. | 升高溫度,K值增大 | |
| C. | K越大,說明該反應的進行程度越大 | |
| D. | 該反應的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
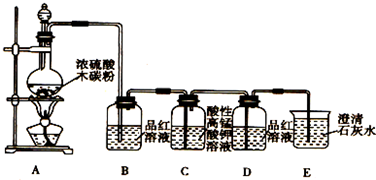
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
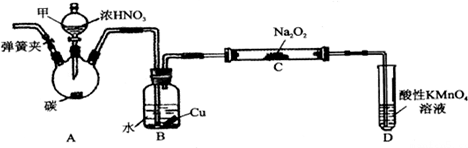
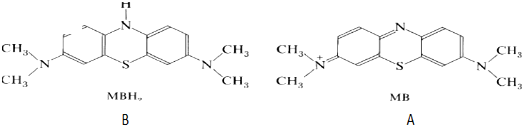
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
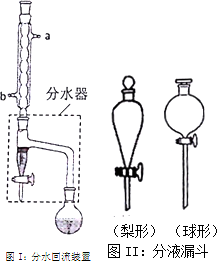 實驗室制備乙酸正丁酯的化學方程式:
實驗室制備乙酸正丁酯的化學方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸點(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com