
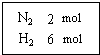 在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:
在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:分析 在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中,
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
變化量(mol):x 3x 2x
平衡量(mol):2-x 6-3x 2x
若反應達到平衡后,測得混和氣體為7mol,則2-x+6-3x+2x=7,解得x=0.5.
(1)改變起始投料量,平衡時各物質的物質的量分數仍與原平衡時完全相同,為等效平衡,恒溫恒容下,按化學計量數轉化到方程式左邊滿足投料量相等,即滿足n(N2)=2mol、n(H2)=6mol;
根據平衡時同種組分的物質的量判斷反應進行方向;
(2)若規定起始時反應向逆反應方向進行,則氨氣物質的量應大于原平衡時的物質的量,氨氣完全轉化得到2mol氮氣、6mol氫氣達極大值;
(3)在上述裝置中,若需控制平衡后的混和氣體的物質的量為6.5mol,應使平衡正向移動.
解答 解:在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中,
N2(g)+3H2(g)?2NH3(g)
起始量(mol):2 6 0
變化量(mol):x 3x 2x
平衡量(mol):2-x 6-3x 2x
若反應達到平衡后,測得混和氣體為7mol,則2-x+6-3x+2x=7,解得x=0.5.
(1)改變起始投料量,平衡時各物質的物質的量分數仍與原平衡時完全相同,為等效平衡,恒溫恒容下,按化學計量數轉化到方程式左邊滿足投料量相等,即滿足n(N2)=2mol、n(H2)=6mol,則1+$\frac{1}{2}$×2mol=2mol、b+$\frac{3}{2}$×2mol=6mol,故b=3mol;
原平衡時氮氣為1.5mol,大于1mol,故反應向逆反應方向進行,
故答案為:3;逆反應;
(2)若規定起始時反應向逆反應方向進行,則氨氣物質的量應大于原平衡時的物質的量,故c>1mol,氨氣完全轉化得到2mol氮氣、6mol氫氣達極大值,氨氣極大值為2mol×2=4mol,故c的取值范圍為:1<c<4,
故答案為:1<c<4;
(3)在上述裝置中,若需控制平衡后的混和氣體的物質的量為6.5mol,應使平衡正向移動,正反應為放熱反應,可以降低溫度使平衡正向移動,
故答案為:降低溫度.
點評 本題考查化學平衡計算與影響因素,側重考查等效平衡,關鍵是對等效平衡規律的理解掌握.


科目:高中化學 來源: 題型:選擇題
| A. |  干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分離沸點相差較大的互溶液體混合物 | |
| D. |  分離互不相溶的兩種液體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 t℃時,將2molSO2和1molO2通入體積為2L的恒溫恒容密閉容器中,發生如下反應:2SO2(g)+O2(g)?2SO3(g),120s時反應達到化學平衡,此時測得反應物O2還剩余0.2mol,請填寫下列空白:
t℃時,將2molSO2和1molO2通入體積為2L的恒溫恒容密閉容器中,發生如下反應:2SO2(g)+O2(g)?2SO3(g),120s時反應達到化學平衡,此時測得反應物O2還剩余0.2mol,請填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲中反應達到平衡時,Q1=Q | |
| B. | 達到平衡后,甲中C的體積分數比乙大 | |
| C. | 達到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移動 | |
| D. | 乙中的熱化學反應方程式為2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,反應C(s)+H2O(g)═CO(g)+H2(g)不能自發進行,則該反應的△H>0 | |
| B. | 一定溫度下,反應MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放熱的自發過程,一定是熵增加的過程 | |
| D. | 液態水可自發揮發成水蒸氣的過程是熵減的過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗目的 | 試劑及方法 |
| 除去細沙中混有的碘 | A |
| 證明某些雨水樣品呈酸性 | C |
| 鑒別甲烷和乙烯 | D |
| 除去開水壺內壁的水垢 | B |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com