
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)化學平衡常數是指:一定溫度下,可逆反應到達平衡時,生成物的濃度系數次冪之積與反應物的濃度系數次冪之積的比,固體、純液體不需要在化學平衡常數中寫出;
(2)由表中數據可知,隨溫度升高平衡常數增大,說明升高溫度平衡正向移動;
(3)某溫度下,各物質的平衡濃度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),則平衡常數K=0.6;
(4)平衡常數只受溫度影響,溫度不變,平衡常數不變;
(5)在其他條件不變的情況下,擴大容器的體積,壓強減小,反應前后氣體的體積不變,平衡不移動;
(6)計算此時濃度商Qc,若Qc=K,處于平衡狀態,若Qc<K,反應向正反應進行,若Qc>K,反應向逆反應進行.
解答 解:(1)CO2(g)+H2(g)?CO(g)+H2O(g)的化學平衡常數表達式K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案為:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
(2)由表中數據可知,隨溫度升高平衡常數增大,說明升高溫度平衡正向移動,則正反應是吸熱反應,
故答案為:吸熱;
(3)某溫度下,各物質的平衡濃度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),則平衡常數K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$=0.6,所處溫度為700℃,
故答案為:700℃;
(4)由表中數據可知,830℃時該平衡常數為1,平衡常數只受溫度影響,與物質的濃度無關,溫度不變平衡常數不變,
故答案為:等于;
(5)其他條件不變的情況下,擴大容器的體積,壓強減小,反應前后氣體的體積不變,平衡不移動,
故答案為:不;
(6)此時濃度商Qc=$\frac{4×4}{2×2}$=4>K=2.6,反應向逆反應進行,
故答案為:逆反應方向.
點評 本題考查化學平衡常數及影響因素、化學平衡影響因素等,難度中等,掌握化學平衡常數的用途:1、判斷反應進行的程度,2、判斷反應的熱效應,3、判斷反應進行的方向,4、計算轉化率等.


 高中必刷題系列答案
高中必刷題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 汞 | B. | 氧化汞 | C. | 氧化鋁 | D. | 硝酸鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 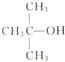 、CH3OH和濃硫酸共熱 、CH3OH和濃硫酸共熱 | B. | 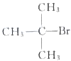 和CH3ONa共熱 和CH3ONa共熱 | ||
| C. | CH3Br和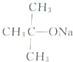 共熱 共熱 | D. |  和CH3OH在Al2O3存在下共熱 和CH3OH在Al2O3存在下共熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
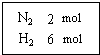 在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:
在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L該溶液中含有H2SO4的質量為9.8 g | |
| B. | 將0.1mol H2SO4溶于1L水中可得該溶液 | |
| C. | 0.5 L該溶液中氫離子的物質的量濃度為0.2 mol•L-1 | |
| D. | 從1 L該溶液中取出100 mL,則取出溶液中H2SO4的物質的量濃度為0.1 mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com