
| A. | 甲中反應達到平衡時,Q1=Q | |
| B. | 達到平衡后,甲中C的體積分數比乙大 | |
| C. | 達到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移動 | |
| D. | 乙中的熱化學反應方程式為2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
分析 A.可逆反應不能完全反應,甲參加反應的A小于1mol;
B.甲容器中開始加入1molA的和3molB與乙容器中開始加入2mol C為完全等效平衡,平衡時同種物質的含量相同;
C.甲容器中開始加入1molA的和3molB與乙容器中開始加入2mol C為完全等效平衡,平衡時相同組分的物質的量相等,設甲中平衡時C為xmol,則乙中反應的C為(2-x)mol,由于Q2=3Q1,則(2-x)mol=3xmol,解得x=0.5,則平衡體系中A為0.5mol、B為1.5mol、C為1mol,再向乙中加入0.25molA、0.75molB、1.5molC,等效為增大壓強,平衡向氣體體積減小的方向移動;
D.可逆反應不能完全反應,2molC分解吸收的熱量大于Q2kJ.
解答 解:A.可逆反應不能完全反應,甲參加反應的A小于1mol,故甲中反應達到平衡時Q1<Q,故A錯誤;
B.甲容器中開始加入1molA的和3molB與乙容器中開始加入2mol C為完全等效平衡,平衡時同種物質的含量相同,則C的體積分數相等,故B正確;
C.甲容器中開始加入1molA的和3molB與乙容器中開始加入2mol C為完全等效平衡,平衡時相同組分的物質的量相等,設甲中平衡時C為xmol,則乙中反應的C為(2-x)mol,由于Q2=3Q1,則(2-x)mol=3xmol,解得x=0.5,則平衡體系中A為0.5mol、B為1.5mol、C為1mol,再向乙中加入0.25molA、0.75molB、1.5molC,等效為增大壓強,平衡向氣體體積減小的方向移動,即向生成C的方向移動,故C正確;
D.可逆反應不能完全反應,2molC分解吸收的熱量大于Q2kJ,乙中熱化學方程式為:2C(g)?A(g)+3B(g)△H=+QkJ/mol,故D錯誤,
故選:C.
點評 本題考查了化學平衡的計算、化學平衡建立、可逆反應特征等,題目難度中等,關鍵是等效平衡的應用,旨在培養學生靈活運用基礎知識解決實際問題的能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 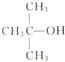 、CH3OH和濃硫酸共熱 、CH3OH和濃硫酸共熱 | B. | 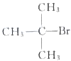 和CH3ONa共熱 和CH3ONa共熱 | ||
| C. | CH3Br和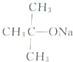 共熱 共熱 | D. |  和CH3OH在Al2O3存在下共熱 和CH3OH在Al2O3存在下共熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
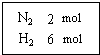 在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:
在一定溫度下,把2mol N2和6mol H2通入一個體積不變的密閉容器 中(如右圖)發生以下的反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com