
分析 (1)根據常見的放熱反應有:所有的物質燃燒、所有金屬與酸反應、金屬與水反應、所有中和反應、絕大多數化合反應和鋁熱反應;
常見的吸熱反應有:絕大數分解反應,個別的化合反應(如C和CO2)、少數置換反應(如C和H2O)、某些復分解(如銨鹽和強堿)和碳、一氧化碳、氫氣等還原金屬氧化物;
(2)根據金屬的活潑性判斷正負極;根據電極上發生反應的類型確定電極反應式;
(3)用鋅片、銅片連接后浸入稀硫酸溶液中,構成了原電池,鋅為負極,電極反應為:Zn-2e-=Zn2+;銅為正極,電極反應為2H++2e-=H2↑;根據兩極轉移電子數目相等計算;
(4)反應物總能量大于生成物總能量,為放熱反應,中和反應為放熱反應,酸和堿反應生成水;
解答 解:(1)①煅燒石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反應,屬于常見的吸熱反應;
②燃燒木炭取暖是物質的燃燒,放出熱量,屬于常見的放熱反應;
③炸藥爆炸要放出熱量,屬于放熱反應;
④酸與堿的中和反應要放熱熱量,屬于常見的放熱反應;
⑤生石灰與水作用制熟石灰,是化合反應,放出熱量,屬于常見的放熱反應;
⑥食物因氧化而腐敗要放熱熱量,屬于放熱反應;
故答案為:②③④⑤⑥;①.(11分)(1)②③④⑤⑥(1分)①(1分)
(2)根據金屬的活潑性判斷,銅作負極,銅失去電子變成離子進入溶液,發生氧化反應,Cu-2 e-=Cu2+;銀作正極,銀離子得電子生成銀單質,發生還原反應,2Ag++2 e-=2Ag;故答案為:Cu;Cu-2e-=Cu2+;
(3)用鋅片、銅片連接后浸入稀硫酸溶液中,構成了原電池,
鋅為負極,電極反應為:Zn-2e-=Zn2+,
銅為正極,電極反應為2H++2e-=H2↑,
鋅片的質量減少了3.25克,則物質的量為$\frac{3.25g}{65g/mol}$=0.05mol,
轉移的電子的物質的量為n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,
則:V(H2)=0.05mol×22.4L/mol=1.12L,
故答案為:1.12L;0.1;
(4)設反應物的總能量為E1,生成物的總能量為E2,若E1>E2,則該反應為放熱反應,放熱反應可以看成儲存在物質內部的能量轉化為熱能等釋放出來;中和反應都是放熱反應,反應的實質為H++OH-═H2O,
故答案為:放;儲存在物質內部的能量轉化為熱能等釋放出來;放;酸電離出的H+與堿電離出的OH-結合成弱電解質水:H++OH-═H2O;
點評 本題考查了放熱反應與吸熱反應的判斷,原電池原理及其計算,以及中和反應的實質,題目難度不大,抓住基礎即可解答.


 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:解答題
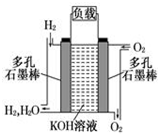 如圖為氫氧燃料堿性電池,電極材料為疏松多孔石墨棒.根據所學知識試回
如圖為氫氧燃料堿性電池,電極材料為疏松多孔石墨棒.根據所學知識試回查看答案和解析>>
科目:高中化學 來源: 題型:解答題
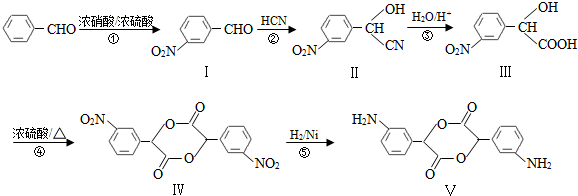
 ,和
,和 .
.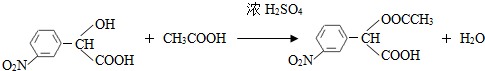 (要求寫出反應條件),
(要求寫出反應條件),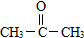 )代替化合物 I發生反應②可以得到化合物Ⅵ,化合物Ⅵ的結構簡式為
)代替化合物 I發生反應②可以得到化合物Ⅵ,化合物Ⅵ的結構簡式為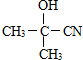 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蠶絲、羊毛、病毒等主要成分都是蛋白質 | |
| B. | 蛋白質溶液中加入飽和(NH4)2SO4溶液,蛋白質析出,再加水,也不溶解 | |
| C. | 重金屬鹽能使蛋白質凝結 | |
| D. | 濃硝酸使皮膚呈黃色是由于濃硝酸與蛋白質發生了顏色反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
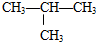 ⑤
⑤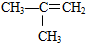
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 任何晶體中都存在化學鍵 | |
| B. | 晶體內部的微粒在空間的排列均服從緊密堆積原理 | |
| C. | 任何晶體中,若有陰離子必定含有陽離子 | |
| D. | 金屬晶體的熔點都比分子晶體的熔點高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鋰亞硫酰氯(Li-SOCl2)電池具有能量密度高、工作電壓和放電電壓平穩、工作溫度范圍寬及貯存壽命長等優點,在航海、醫療及井下油田設備等方面的應用廣泛.
鋰亞硫酰氯(Li-SOCl2)電池具有能量密度高、工作電壓和放電電壓平穩、工作溫度范圍寬及貯存壽命長等優點,在航海、醫療及井下油田設備等方面的應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
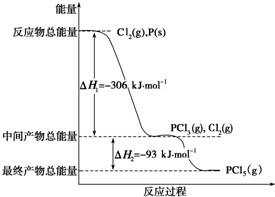 已知紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g),反應過程和能量關系如圖所示(圖中的△H表示生成1mol產物的數據).
已知紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g),反應過程和能量關系如圖所示(圖中的△H表示生成1mol產物的數據).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com