
 鋰亞硫酰氯(Li-SOCl2)電池具有能量密度高、工作電壓和放電電壓平穩、工作溫度范圍寬及貯存壽命長等優點,在航海、醫療及井下油田設備等方面的應用廣泛.
鋰亞硫酰氯(Li-SOCl2)電池具有能量密度高、工作電壓和放電電壓平穩、工作溫度范圍寬及貯存壽命長等優點,在航海、醫療及井下油田設備等方面的應用廣泛.分析 (1)活潑金屬和活潑非金屬元素之間易形成離子鍵,同種非金屬元素之間易形成非極性鍵,不同非金屬元素之間易形成極性鍵,分子晶體中存在范德華力,金屬晶體中存在金屬鍵;
(2)SOCl2中O元素為-2價、Cl元素為-1價,根據化合價的代數和為0確定S元素化合價;1個SOCl2中的σ鍵數目是3,元素非金屬性越強,其電負性越大;
(3)Fe是26號元素,其原子核外有26個電子,Fe原子失去最外層2個電子生成Fe2+,其3d能級上5個電子為其價電子;配位鍵由含有孤電子對的原子指向含有空軌道的原子;
(4)鋰鍵應該是Li原子和F原子形成的分子間作用力.
解答 解:(1)活潑金屬和活潑非金屬元素之間易形成離子鍵,同種非金屬元素之間易形成非極性鍵,不同非金屬元素之間易形成極性鍵,分子晶體中存在范德華力,金屬晶體中存在金屬鍵,
該反應中Li中存在金屬鍵,SOCl2和SO2中存在極性鍵和范德華力,S中存在非極性鍵和范德華力,LiCl中存在離子鍵,所以只有氫鍵不存在,故選c;
(2)SOCl2中O元素為-2價、Cl元素為-1價,根據化合價的代數和為0確定S元素化合價為+4價;1個SOCl2中的σ鍵數目是3,所以1molSOCl2中的σ鍵數目是3NA;元素非金屬性越強,其電負性越大,這幾種元素電負性大小順序是O>Cl>S,
故答案為:+4;3NA;O>Cl>S;
(3)Fe是26號元素,其原子核外有26個電子,Fe原子失去最外層2個電子生成Fe2+,其3d能級上5個電子為其價電子,則其價電子排布式為3d6;配位鍵由含有孤電子對的原子指向含有空軌道的原子,配位鍵表示為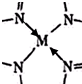 ,故答案為:3d6;
,故答案為:3d6; ;
;
(4)鋰鍵應該是Li原子和F原子形成的分子間作用力,故選b.
點評 本題考查物質結構和性質,為高頻考點,涉及配位鍵、鋰鍵、電負性、原子核外電子排布等知識點,難點是配位鍵表示方法,(4)題以氫鍵為例采用知識遷移方法解答,注意配位鍵屬于共價鍵、氫鍵屬于分子間作用力.


 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | 操作 | 現象 | 結論 |
| A | 將飽和FeCl3溶液滴入沸水中 | 溶液變紅褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加鹽酸 | 產生氣泡 | Cl的非金屬性比S強 |
| C | 向溶液中滴加鹽酸酸化的BaCl2溶液 | 產生白色沉淀 | 溶液中含有SO42- |
| D | 用導線連接銅片和鋅片后插進鹽酸中 | 銅片上有氣泡 | 銅片是原電池的正極 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.為證明濃硫酸在實
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.為證明濃硫酸在實| 實驗 編號 | 試管1中的試劑 | 試管2中試劑 | 測得有機層的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L濃硫酸 | 飽和碳酸鈉溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
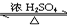 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
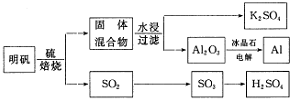
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
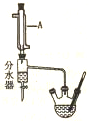 實驗室用乙酸和正丁醇制備乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH2CH2CH3+H2O有關物質的相關數據如下表.
實驗室用乙酸和正丁醇制備乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{濃硫酸}$CH3COOCH2CH2CH2CH3+H2O有關物質的相關數據如下表.| 化合物 | 相對分子質量 | 密度g.cm-3 | 沸點/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com