
| A. | 任何濃度的溶液都可以用pH來表示其酸堿性的強弱 | |
| B. | 某溶液中由水電離出的c(OH-)=1×10-a mol•L-1,若a>7,則該溶液的pH一定為14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 無論是純水,還是酸性、堿性或中性稀溶液,在常溫下,其c(H+)•c(OH-)=1×10-14 |
分析 A.根據溶液的酸堿度用PH來表示,其范圍一般在 0~14之間進行判斷;
B.由水電離出的c(H+)=l×10-amol•L-1,該溶液可能是酸性溶液,也可能是堿性溶液,據此計算判斷,注意為酸性溶液時,溶液中氫氧根離子濃度等于水電離的氫離子濃度,利用水的離子積計算溶液中氫離子,再根據pH=-logc(H+)計算pH值;
C.醋酸濃度增大,電離程度減小;
D.根據常溫下溫度離子積進行判斷.
解答 解:A.pH范圍一般在 0~14之間,溶液中的氫離子在1~10-14mol/L,故A錯誤;
B.由水電離出的c(H+)=l×10-amol•L-1,該溶液若為酸性溶液,則溶液中c(OH-)=l×10-amol•L-1,故溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-a}}$mol/L=l×10-14+amol/L,故pH=-logl×10-14+a=14-a,該溶液若為堿性溶液,則溶液pH=-logl×10-a=a,若a>7,則該溶液的pH為7或14-a,故B錯誤;
C.醋酸是弱電解質,濃度增大,醋酸的電離程度減小,所以0.2 mol/L CH3COOH溶液中的c(H+)小于0.1 mol/L CH3COOH溶液中的c(H+)的2倍,故C錯誤;
D.水的離子積只與溫度有關,所以常溫下Kw=c(H+)•c(OH-)=1×10-14,與溶液的酸堿性無關,故D正確;
故選D.
點評 本題考查了弱電解質的電離平衡及其影響,題目難度中等,注意掌握影響電離平衡的因素,明確溶液酸堿性與溶液pH的關系,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 紅色石蕊試紙檢驗NH3 | B. | 品紅試紙檢驗SO2 | ||
| C. | 碘化鉀淀粉試紙檢驗Cl2 | D. | pH試紙檢驗溶液的pH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 明朝的《本草綱目》記載“燒酒非古法也,自元時創始,其法用濃酒和糟入甑(指蒸鍋),蒸令氣上,用器承滴露.”該段文字記載了白酒(燒酒)的制造過程中采用了蒸餾的方法來分離和提純 | |
| B. | 漢朝的《淮南萬畢術》、《神農本草經》記載“白青(堿式碳酸銅)得鐵化為銅”,“石膽…能化鐵為銅”都是指銅可以采用濕法冶煉 | |
| C. | 清初《泉州府志》物產條載:“初,人不知蓋泥法,元時南安有黃長者為宅煮糖,宅垣忽壞,去土而糖白,后人遂效之.”該段文字記載了蔗糖的分離提純采用了黃泥來吸附紅糖中的色素 | |
| D. | 晉代葛洪的《抱樸子》記載“丹砂燒之成水銀,積變又成丹砂”,是指加熱時丹砂(HgS)熔融成液態,冷卻時重新結晶為HgS晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知FeO4n-中Fe的化合價是+6價,則n=2 | |
| B. | 每產生1molCl-,轉移2mol電子 | |
| C. | FeO4n-具有強氧化性,一般其還原產物為Fe3+,可用作新型自來水消毒劑和凈水劑 | |
| D. | 若n=2,該反應中氧化劑與還原劑的物質的量之比為2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| , | 實驗操作 | 預期現象 | 結 論 |
| 驗證猜想I] | 步驟①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫紅色褪去 | 含有Fe2+ |
| 步驟②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不變為藍色 | 不含Fe3+ | |
| 驗證猜想Ⅱ | 將所得氣體通入如下裝置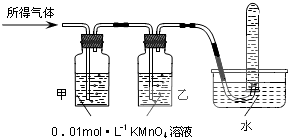 | 甲中KMnO4溶液褪色,乙中KMnO4溶液顏色不變,試管中收集到氣體 | 含有兩種氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
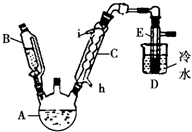 如圖所示是實驗室用濃硫酸、溴化鈉(先生成HBr)與乙醇反應來制備溴乙烷(C2H5Br)的裝置,反應需要加熱,圖中省去了夾持與加熱裝置,有關物質的性質如下表.
如圖所示是實驗室用濃硫酸、溴化鈉(先生成HBr)與乙醇反應來制備溴乙烷(C2H5Br)的裝置,反應需要加熱,圖中省去了夾持與加熱裝置,有關物質的性質如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情況下狀態 | 無色液體 | 無色液體 | 深紅棕色液體 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸點/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com