
| , | 實驗操作 | 預期現象 | 結 論 |
| 驗證猜想I] | 步驟①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫紅色褪去 | 含有Fe2+ |
| 步驟②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不變為藍色 | 不含Fe3+ | |
| 驗證猜想Ⅱ | 將所得氣體通入如下裝置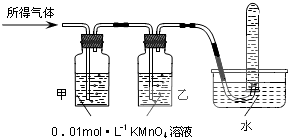 | 甲中KMnO4溶液褪色,乙中KMnO4溶液顏色不變,試管中收集到氣體 | 含有兩種氣體 |
分析 【提出猜想】濃硫酸和鐵反應生成二氧化硫,稀硫酸和鐵反應生成氫氣,據此進行猜想;
【實驗探究】
驗證猜想Ⅰ、根據二價鐵離子和三價鐵離子的性質選擇試劑,并根據反應物和生成物預測現象,由此得出結論;
驗證猜想Ⅱ、根據氫氣和二氧化硫的性質選擇試劑,并預測現象,由現象得出結論.
解答 解:【提出猜想】濃硫酸和鐵反應生成二氧化硫,稀硫酸和鐵反應生成氫氣,所以所得氣體中可能含有SO2、H2,故答案為:SO2、H2;
【實驗探究】
驗證猜想Ⅰ、
酸性高錳酸鉀有強氧化性,二價鐵離子有還原性,所以酸性高錳酸鉀能和二價鐵離子發生氧化還原反應,如果步驟①溶液紫紅色褪去,說明含有二價鐵離子,否則沒有.
碘化鉀有還原性,三價鐵離子有氧化性,碘離子和三價鐵離子能發生氧化還原反應生成單質碘,碘遇淀粉變藍色,所以步驟②另取少量所得溶液,滴加KI溶液和淀粉溶液,如果溶液變為藍色,說明含有三價鐵離子,否則沒有,
猜想Ⅱ、
二氧化硫有還原性,能和強氧化性的物質發生氧化還原反應,如能使酸性高錳酸鉀溶液褪色,氫氣不能使酸性高錳酸鉀溶液褪色,但氫氣不易溶于水,所以如果甲中KMnO4溶液褪色,說明含有二氧化硫;乙中KMnO4溶液顏色不變,說明二氧化硫完全被吸收,如果試管中收集氣體,只能是氫氣,
故答案為:
| 實驗操作 | 預期現象 | 結 論 | |
| 驗證猜想I] | 溶液紫紅色褪去 | ||
| 另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不變為藍色 | ||
| 驗證猜想Ⅱ | 甲中KMnO4溶液褪色,乙中KMnO4溶液顏色不變,試管中收集到氣體 |
點評 本題考查了二價鐵離子和三價鐵離子的檢驗,為高頻考點,側重于學生的分析能力和實驗設計能力的考查,難度不大,注意常溫下,濃硫酸和鐵能發生鈍化現象,鈍化現象是鐵和濃硫酸反應生成一層致密的氧化物薄膜,不是不反應.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
 ,其中氧化劑是MnO2,還原劑是HCl.
,其中氧化劑是MnO2,還原劑是HCl.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 任何濃度的溶液都可以用pH來表示其酸堿性的強弱 | |
| B. | 某溶液中由水電離出的c(OH-)=1×10-a mol•L-1,若a>7,則該溶液的pH一定為14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 無論是純水,還是酸性、堿性或中性稀溶液,在常溫下,其c(H+)•c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
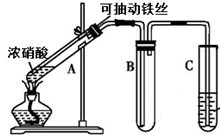 某校化學興趣小組利用如圖所示裝置進行探究鐵與濃硝酸的反應.
某校化學興趣小組利用如圖所示裝置進行探究鐵與濃硝酸的反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
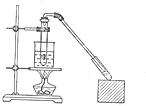 乙酸和乙醇反應的裝置如圖所示:在試管里加入3mL乙醇,然后一邊攪動,一邊慢慢地加入2mL濃硫酸和2mL冰醋酸,用酒精燈小心均勻地加熱10min,將產生的蒸氣經長導管通入到小試管中溶液的液面上.
乙酸和乙醇反應的裝置如圖所示:在試管里加入3mL乙醇,然后一邊攪動,一邊慢慢地加入2mL濃硫酸和2mL冰醋酸,用酒精燈小心均勻地加熱10min,將產生的蒸氣經長導管通入到小試管中溶液的液面上.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
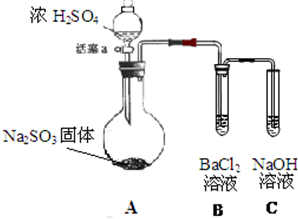 某同學設計了如下實驗裝置圖.(夾持裝置和加熱裝置略,氣密性已檢驗):
某同學設計了如下實驗裝置圖.(夾持裝置和加熱裝置略,氣密性已檢驗):查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
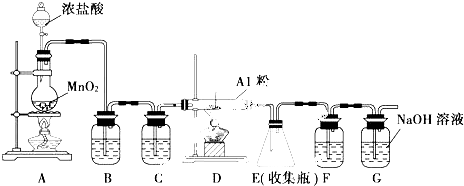
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com