
| 離子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范圍 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
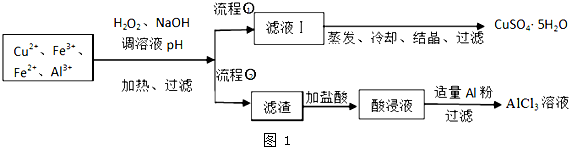
分析 加H2O2把Fe2+氧化為Fe3+,加氫氧化鈉調節pH,生成氫氧化鐵和氫氧化鋁沉淀,過濾得濾渣中含氫氧化鐵和氫氧化鋁,加過量鹽酸生成氯化鋁、氯化鐵,酸浸液加入適量鋁把鐵置換出來,過濾得到氯化鋁;對于濾液I,含硫酸銅,通過蒸發濃縮、冷卻結晶、過濾洗滌得到硫酸銅晶體,
(1)加H2O2的作用是把Fe2+氧化為Fe3+,該氧化劑的優點是不引入雜質,產物對環境物污染;濾渣c是氫氧化鋁,根據部分陽離子以氫氧化物形式沉淀時溶液的pH表,選擇使氫氧化鋁沉淀完全且氫氧化銅不沉淀的pH;
(2)雙氧水具有氧化性,能夠將亞鐵離子氧化成鐵離子;
(3)加入金屬鋁可以將溶液中鐵離子、氫離子除去;
(4)氯化鋁屬于強酸弱堿鹽,會發生水解生成氫氧化鋁和氯化氫,氯化氫具有揮發性,最終生成氧化鋁;
(5)根據圖象曲線變化及發生反應原理進行計算.
解答 解:加H2O2把Fe2+氧化為Fe3+,加氫氧化鈉調節pH,生成氫氧化鐵和氫氧化鋁沉淀,過濾得濾渣中含氫氧化鐵和氫氧化鋁,加過量鹽酸生成氯化鋁、氯化鐵,酸浸液加入適量鋁把鐵置換出來,過濾得到氯化鋁;對于濾液I,含硫酸銅,通過蒸發濃縮、冷卻結晶、過濾洗滌得到硫酸銅晶體,
(1)第②步加H2O2的作用是將Fe2+氧化為Fe3+,過氧化氫做氧化劑不引入雜質,對環境無污染;
加入氫氧化鈉溶液調節PH=x,目的是生成氫氧化鋁沉淀,氫氧化鋁開始沉淀PH=4,沉淀完全PH=5.0,氫氧化銅開始沉淀PH=5.4,所以選擇的PH范圍是:5.0≤X<5.4,pH至少應調至5.0,
故答案為:將Fe2+氧化為Fe3+;5.0;
(2)亞鐵離子被雙氧水氧化成鐵離子,反應的離子方程式為:H2O2+2Fe2++2H+═2Fe3++2H2O,
故答案為:H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入適量Al粉,將酸浸液中的鐵離子和氫離子反應,從而除去鐵離子和氫離子,
故答案為:與酸浸液中Fe3+和H+反應生成Al3+;
(4)氯化鋁為強酸弱堿鹽,水解反應方程式為:AlCl3+3H2O?Al(OH)3+3HCl水解為吸熱反應,加熱使水解平衡向水解方向移動,蒸干,氯化氫揮發,得到氫氧化鋁,灼燒氫氧化鋁得到氧化鋁,
故答案為:不能;直接加熱AlCl3溶液,會發生水解反應,最終得到氧化鋁;
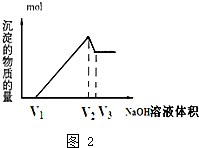
(5)0-V1階段,滴加的NaOH用于中和剩余的HCl,發生反應為:HCl+NaOH=NaCl+H2O,
設Fe3+、Al3+物質的量分別為y、x,
V1-V2階段,繼續滴加的NaOH與Fe3+、Al3+反應:
Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓
x 3x x y 3y
則:①3x+3y=(V2-V1)×a,
V2-V3階段,繼續滴加的NaOH與Al(OH)3反應,沉淀量開始減少,發生反應:
Al(OH)3+NaOH=NaAlO2+2H2O
x x
則②x=(V3-V2)×a=(V3-V2)amol,
①②解得:y=$\frac{4{V}_{2}-{V}_{1}-{3V}_{3}}{3}$amol,
y:x=$\frac{4{V}_{2}-{V}_{1}-{3V}_{3}}{3}$amol:(V3-V2)amol=$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$,
故答案為:$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.
點評 本題考查性質實驗方案的設計、物質的分離與提純方法的綜合應用,題目難度較大,明確實驗目的為解答關鍵,注意掌握物質分離和提純的操作方法,試題培養了學生的分析、理解能力及化學實驗能力.


 金鑰匙試卷系列答案
金鑰匙試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Cu2S是火法煉銅一種重要的原料,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:
Cu2S是火法煉銅一種重要的原料,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
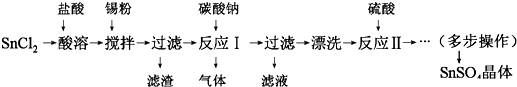
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種溶液中,由水電離出的氫離子濃度均為1×10-11 mol•L-1 | |
| B. | 分別加水稀釋100倍后,兩種溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分別加入足量鋅片,兩種溶液生成H2的體積相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
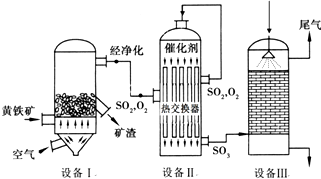
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

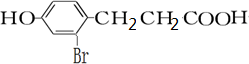 .
.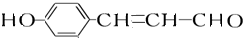 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$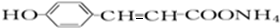 +2Ag↓+3NH3+H2O,反應類型為氧化反應.
+2Ag↓+3NH3+H2O,反應類型為氧化反應.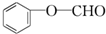 ,
,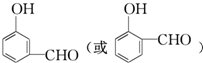 .
. +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com