
分析 (1)①A.用碳酸鹽作轉化劑,將鉛膏中的硫酸鉛轉化為碳酸鉛,說明碳酸鉛的溶解度小于硫酸鉛;
B.濃度不變不一定相等;
C.反應的平衡常數K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$,其分子和分母同乘以鉛離子的濃度結合Ksp分析;
②碳酸根離子濃度越大硫酸鉛的轉化率越高,而碳酸鈉直接電離產生碳酸根離子,而碳酸氫鈉是多元弱酸的酸式鹽,鹽電離產生的酸根離子碳酸氫根離子微弱的電離產生碳酸根離子;
(2)溶液中得到溶質晶體的方法為蒸發濃縮、冷卻結晶、過濾洗滌、干燥等操作;該晶體的陰離子為硫酸根離子,根據檢驗硫酸根離子的方法解答;
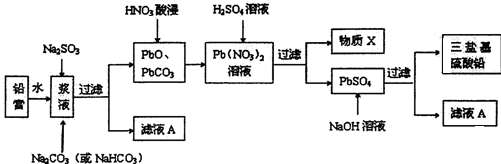
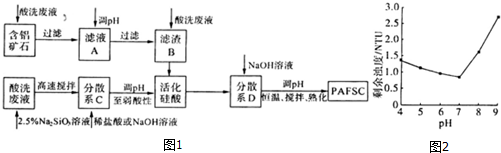
(3)根據制取流程可知,利用廢舊鉛蓄電池陰、陽極填充物(鉛膏)制備塑料加工熱穩定劑三鹽基硫酸鉛實驗流程.向鉛膏漿液中加入Na2SO3溶液的目的是將PbO2還原PbO,Na2SO3+PbO2=PbO+Na2SO4,加Na2CO3溶液是將PbSO4轉化成PbCO3,所以濾液Ⅰ主要是Na2SO4溶液.PbO和PbCO3在硝酸的作用下轉化成Pb(NO3)•Pb(NO3)中加稀H2SO4轉化成PbSO4和硝酸,因此X為HNO3;
若母液中殘留的SO42-過多,浸出時部分鉛離子生成PbSO4隨浸出渣排出,降低PbSO4的產率;
(4)根據流程可知,PbSO4與氫氧根離子反應生成三鹽基硫酸鉛,據此寫出反應的離子方程式;
(5)根據電子守恒可得關系式Na2SO3~2e-~PbO2,則n(Na2SO3)=n( PbO2),再根據V=$\frac{n}{c}$計算出需要0.5mol/L Na2SO3溶液的體積.
解答 解:(1)①A.用碳酸鹽作轉化劑,將鉛膏中的硫酸鉛轉化為碳酸鉛,說明碳酸鉛的溶解度小于硫酸鉛,所以PbSO4的Ksp比PbCO3的Ksp大,故正確;
B.濃度不變不一定相等,故錯誤;
C.根據反應的平衡常數的表達式書寫,K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$的分子和分母同乘以鉛離子的濃度,即K=$\frac{{K}_{SP}(PbS{O}_{4})}{{K}_{SP}(PbC{O}_{3})}$,故正確;
故選:B;
②碳酸根離子濃度越大硫酸鉛的轉化率越高,而碳酸鈉直接電離產生碳酸根離子,而碳酸氫鈉是多元弱酸的酸式鹽,鹽電離產生的酸根離子碳酸氫根離子微弱的電離產生碳酸根離子,所以同濃度的兩種鹽,碳酸鈉溶液中的碳酸根離子濃度大于碳酸氫鈉溶液中碳酸根離子的濃度,
故答案為:Na2CO3;相同濃度的Na2CO3和NaHCO3溶液中,前者c(CO32-)較大;
(2)回收Na2SO4•10H2O,溫度不宜過高,否則容易失去結晶水,所以溶液中得到溶質晶體的方法為:蒸發濃縮,冷卻結晶,過濾洗滌,干燥等;Na2SO4•10H2O中陰離子為SO42-,檢驗硫酸根離子的方法為:取少量晶體溶于蒸餾水,然后用鹽酸酸化,再滴BaCl2溶液,若出現白色沉淀,即證明該晶體中含有SO42-,
故答案為:蒸發濃縮;冷卻結晶;取少量晶體溶于蒸餾水,然后用鹽酸酸化,再滴BaCl2溶液,若出現白色沉淀,即證明該晶體中含有SO42-;
(3)由流程可知,PbO和PbCO3在硝酸的作用下轉化成Pb(NO3)2 ,Pb(NO3)2中加稀H2SO4轉化成PbSO4和硝酸,因此X為HNO3,HNO3在反應流程中可循環利用;
若母液中殘留的SO42-過多,浸出時部分鉛離子會與SO42-反應生成PbSO4隨浸出渣排出,降低了PbSO4的產率,
故答案為:HNO3 ;浸出時部分鉛離子生成PbSO4隨浸出渣排出,降低PbSO4的產率;
(4)硫酸鉛在堿溶液中與氫氧根離子反應生成三鹽基硫酸鉛,反應的離子方程式為:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O,
故答案為:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O;
(5)向鉛膏漿液中加入Na2SO3溶液的目的是將PbO2還原為PbO,若實驗中所取鉛膏漿液質量為47.8g,其中PbO2的質量分數為15.0%,要將PbO2還原,加入的亞硫酸鈉依據化學方程式定量關系和電子守恒計算得到:Na2SO3~2e-~PbO2,
則:n(Na2SO3)=n( PbO2)=$\frac{47.8g×15%}{239g/mol}$=0.03mol,
所以需要亞硫酸鈉溶液的體積為:$\frac{0.03mol}{0.5mol/L}$=0.06L=60mL,
故答案為:60.
點評 本題通過三鹽基硫酸鉛的制備流程,考查了物質制備方案的設計方法,題目難度中等,注意掌握物質制備方案的設計原則,正確分析制備流程得出物質的制備原理為解答此類題的關鍵,試題有利于提高學生的分析、理解能力及化學實驗能力,試題的綜合性較強,是一道質量較好的題目.


科目:高中化學 來源: 題型:解答題
 的系統名稱是3,4-二甲基-3-乙基己烷
的系統名稱是3,4-二甲基-3-乙基己烷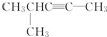 系統命名為4-甲基-2-戊炔
系統命名為4-甲基-2-戊炔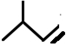
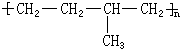 所示,形成該高聚物的單體的結構簡式分別
所示,形成該高聚物的單體的結構簡式分別查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
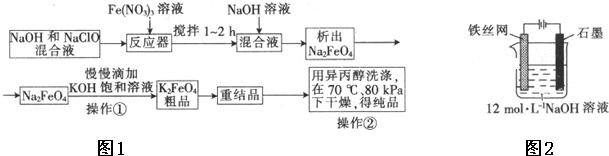
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
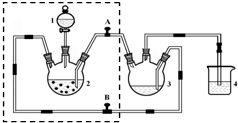 醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:
醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
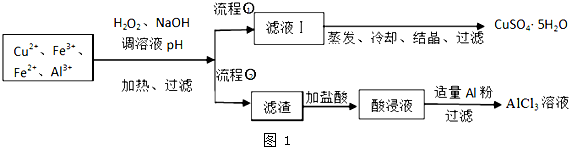
| 離子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范圍 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
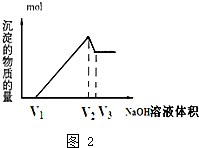
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 成份 | 濃度/(mol•L-1) | 質量分數 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com