
 Cu2S是火法煉銅一種重要的原料,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:
Cu2S是火法煉銅一種重要的原料,下面是由Cu2S冶煉銅及制取CuSO4•5H2O的流程圖:分析 (1)化合物中各元素化合價的代數和為0;依據流程中Cu2S與O2反應得到Cu寫出方程式即可;
(2)氧化亞銅和稀硫酸反應生成硫酸銅和銅,氧化銅和稀硫酸反應生成硫酸銅;
(3)溶解時要加入氧化劑使銅被氧化,且不能引進新的雜質;
(4)根據pH變化求出氫離子的物質的量變化,根據電解方程式計算轉移的電子數;
(5)固體質量減少時,膽礬開始分解,根據減少的質量確定b、c段固體的化學式,從而確定發生的反應,根據最終剩余固體的質量采用假設的方法確定物質的組成.
解答 解:(1)化合物中各元素化合價代數和為0,O元素的化合價為-2價,所以Cu元素的化合價為+1價;Cu2S與O2反應得到Cu,Cu的化合價降低,故S的化合價升高,反應為:Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2,故答案為:+1;Cu2S+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+SO2;
(2)氧化亞銅和稀硫酸反應生成硫酸銅、銅和水,生成紅色物質的離子方程式為:Cu2O+2H+=Cu+Cu 2++H2O,
故答案為:Cu2O+2H+=Cu+Cu 2++H2O;
(3)溶解時要加入氧化劑使銅被氧化,且不能引進新的雜質,硝酸具有強氧化性但引進雜質離子,氫氧化鈉沒有氧化性且能引進雜質離子,雙氧水具有強氧化性且不引進雜質離子,故選C;
故答案為:C;
(4)若硫酸銅溶液的體積為0.2L,電解溶液一段時間后溶液的pH由2變為1,則電解生成的氫離子為0.2L×(0.1-0.01)mol/L=0.018mol,
電極方程式為:2H2O-4e-=O2↑+4H+,則n(e-)=n(H+)=0.018mol;
故答案為:0.018mol;
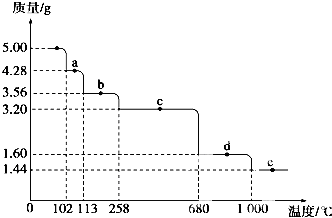
(5)硫酸銅的物質的量=$\frac{5.00g}{250g/mol}$=0.02mol,根據膽礬的化學式知,結晶水的質量=0.02mol×5×18g/mol=1.8g,當固體質量減少1.8g時膽礬完全分解,258℃時,固體減少的質量=5.00g-3.20g=1.80g,所以C段固體是硫酸銅,b段物質減少的質量=5.00g-3.56g=1.44g,則失去的水的物質的量=$\frac{1.44g}{18g/mol}$=0.08mol,則固體中剩下水的物質的量為0.02mol×5-0.08mol=0.02mol,則b段固體的化學式為CuSO4.H2O,該反應方程式為:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;
e點時固體質量為1.44g,銅的質量=0.02mol×64g/mol=1.28g,則另一種元素質量為1.44g-1.28g=0.16g,如果另一種元素是S元素,則硫的物質的量為$\frac{0.16g}{32g/mol}$=0.005mol,銅原子的物質的量為0.02mol,則Cu和S的個數比為4:1,不符合化合價原則,所以另一種元素是氧元素,其物質的量為$\frac{0.16g}{16g/mol}$=0.01mol,所以其化學式為Cu2O,
故答案為:CuSO4•H2O $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;Cu2O.
點評 本題考查了物質的量的有關計算,結合元素化合價變化及氧化還原反應來分析解答,難點是(4)題,根據固體質量變化確定每一段物質的組成,從而確定每一段發生的反應,難度中等.


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈣(CaO2)的電子式: | |
| B. | 816O2-離子的結構示意圖: | |
| C. | H2CO3的電離方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的結構簡式:C6H12O6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 干電池原理示意圖如圖,電池總反應為:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列說法正確的是( )
干電池原理示意圖如圖,電池總反應為:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列說法正確的是( )| A. | 碳為電池的正極 | |
| B. | Zn極上發生還原反應 | |
| C. | 常見鋅錳干電池為二次電池 | |
| D. | 反應2NH4++2e-=2NH3↑+H2↑在負極上發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合價 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B簡單離子半徑大小關系為B3+>A2+ | |
| B. | D、E形成的簡單離子的還原性:E->D- | |
| C. | 氣態氫化物的穩定性:HD<H2C | |
| D. | 最高價氧化物對應的水化物的酸性:H2CO4>HEO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
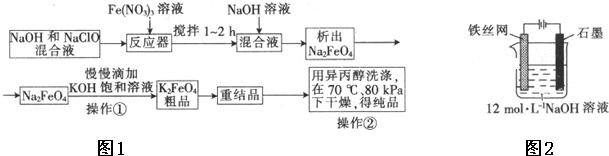
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
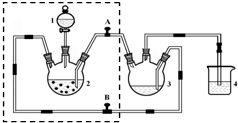 醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:
醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
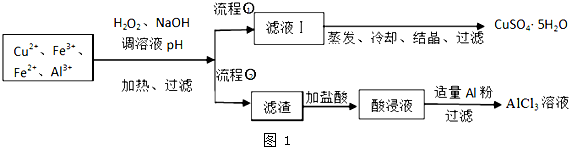
| 離子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范圍 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于元素周期表和元素周期律的發現有突出貢獻的科學家是阿伏加德羅 | |
| B. | 元素周期表根據相對原子質量從小到大的順序排列 | |
| C. | 現常見的元素周期表有七個橫行,分為七個周期,有18個縱行,分為16個族 | |
| D. | 每一周期都是從金屬元素開始,非金屬元素結束 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com