
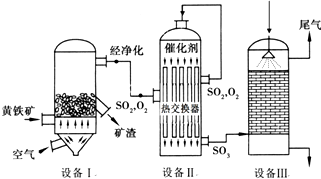
分析 以黃鐵礦(主要成分是FeS2)為原料生產硫酸的工藝流程圖:
第一步:SO2的制取.主要原料是黃鐵礦和空氣,在高溫下煅燒,使硫元素轉變成SO2氣體,反應方程式為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2,設備為沸騰爐.黃鐵礦需要粉碎,以增大和空氣的接觸面;
第二步:SO3的制取.從沸騰爐中出來的氣體需經過凈化、除塵,以防止催化劑中毒,進入接觸室在催化劑作用下SO2和O2反應生成SO3,設備為接觸室,同時涉及熱量的交換、催化劑的作用、平衡的移動等問題;
第三步:硫酸的生成.從接觸室中出來的氣體進入吸收塔,為避免酸霧形成需用濃H2SO4吸收,以此解答(1)(2);
(3)常壓時SO2的轉化率已經很高,采用高壓增加設備成本;提高催化劑效率可以凈化氣體、控制溫度、增大催化劑接觸面積;
(4)在吸收塔中用水吸收三氧化硫,反應放熱易形成酸霧阻止對三氧化硫的吸收;濃硫酸的沸點高,難以氣化,不會形成酸霧,同時三氧化硫易溶于濃硫酸,吸收塔中填充許多瓷管,增大三氧化硫與濃硫酸的接觸面,有利于三氧化硫的吸收;
(5)二氧化硫吸收溴單質利用的是二氧化硫的還原性和溴單質的氧化性,根據氧化還原反應書寫離子方程式.
解答 解:(1)A.在沸騰爐中,原料黃鐵礦是固體、空氣是氣體,為了加快反應速率,所以要將黃鐵礦粉碎,增大接觸面,提高反應速率,故A正確;
B、轉化率=已轉化的原料的量/原料的總量×100%,接觸室中反應2SO2+O2$?_{△}^{催化劑}$2SO3,為可逆反應,采用空氣過量目的是增大氧氣濃度,促使平衡正向移動,導致SO2更多的轉化成SO3,所以SO2轉化率提高,故B正確;
C.沸騰爐排出的礦渣為F2O3,F2O3可供煉鐵,故C正確;
D.催化劑只能改變反應速率,不能影響轉化率,故D錯誤;
E.設備I生成的氣體經凈化的主要目的是防止催化劑中毒,故E正確;
F.熱交換器的目的是使SO2的熱量傳遞給SO3,有利于SO2的氧化,但不利于SO3的吸收,故F錯誤;
故答案為:DF;
(2)設備Ⅰ的名稱為沸騰爐,反應方程式為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2,故答案為:沸騰爐;4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;
(3)采用常壓而不采用高壓的原因是常壓時SO2的轉化率已經很高,采用高壓對SO2的轉化率提高不多,卻會大大增加設備成本;在生產中,為提高催化劑效率采取的措施有通過凈化氣體、控制溫度在400~500℃、增大催化劑與反應氣體的接觸面積可以提高催化劑效率;
故答案為:常壓時SO2的轉化率已經很高,采用高壓對SO2的轉化率提高不多卻會大大增加設備成本;凈化氣體、控制溫度在400~500℃;增大催化劑與反應氣體的接觸面積等;
(4)吸收塔中SO3如果用水吸收,發生反應:SO3+H2O═H2SO4,該反應為放熱反應,放出的熱量易導致酸霧形成,阻隔在三氧化硫和水之間,阻礙水對三氧化硫的吸收;而濃硫酸的沸點高,難以氣化,不會形成酸霧,同時三氧化硫易溶于濃硫酸,所以工業上從吸收塔頂部噴灑98.3%的硫酸作吸收液,最終得到“發煙”硫酸;吸收塔中填充許多瓷管,增大三氧化硫與濃硫酸的接觸面,有利于三氧化硫的吸收;
故答案為:98.3%的硫酸;發煙硫酸(或濃硫酸);避免產生酸霧降低吸收效率;增加SO3與濃硫酸的接觸面,有利于SO3的吸收;
(5)SO2吸收Br2的反應中二氧化硫被氧化為硫酸,溴單質被還原為溴化氫,離子方程式為SO2+Br2+2H2O=4H++2Br-+SO42-,故答案為:SO2+Br2+2H2O=4H++2Br-+SO42-.
點評 本題是對化學與技術及工業生產的考查,需要學生細讀生產工藝圖中各物質的變化進行解答,把握制備濃硫酸的工藝流程及設備的作用、發生的化學反應為解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
 干電池原理示意圖如圖,電池總反應為:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列說法正確的是( )
干電池原理示意圖如圖,電池總反應為:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列說法正確的是( )| A. | 碳為電池的正極 | |
| B. | Zn極上發生還原反應 | |
| C. | 常見鋅錳干電池為二次電池 | |
| D. | 反應2NH4++2e-=2NH3↑+H2↑在負極上發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
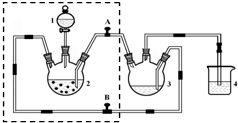 醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:
醋酸亞鉻水合物([Cr(CH3COO)2)]2•2H2O,深紅色晶體)是一種氧氣吸收劑,通常以二聚體分子存在,不溶于冷水和醚,微溶于醇,易溶于鹽酸.實驗室制備醋酸亞鉻水合物的裝置如圖所示,涉及的化學方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
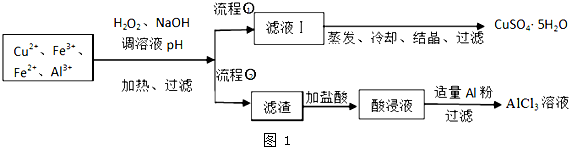
| 離子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范圍 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
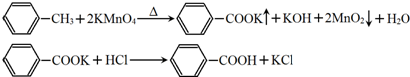
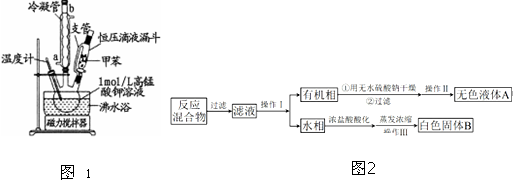
| 序號 | 實驗方案 | 實驗現象 | 結論 |
| ① | 將白色固體加入水中,加熱溶解,冷卻結晶、過濾. | 得到白色晶體和無色溶液 | ╲ |
| ② | 取少量濾液于試管中,滴入適量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 濾液含Cl- |
| ③ | 干燥白色晶體,加熱使其熔化,測其熔點. | 白色晶體在122.4℃左右時完全熔化 | 白色晶體是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 體積(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 成份 | 濃度/(mol•L-1) | 質量分數 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
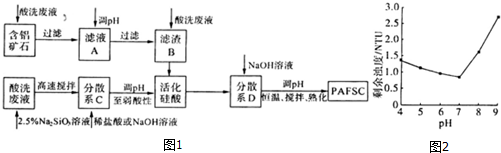
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對于元素周期表和元素周期律的發現有突出貢獻的科學家是阿伏加德羅 | |
| B. | 元素周期表根據相對原子質量從小到大的順序排列 | |
| C. | 現常見的元素周期表有七個橫行,分為七個周期,有18個縱行,分為16個族 | |
| D. | 每一周期都是從金屬元素開始,非金屬元素結束 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
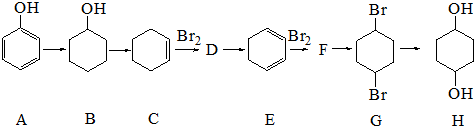
 +2NaOH$\stackrel{醇△}{→}$
+2NaOH$\stackrel{醇△}{→}$ +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→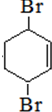 .
. +O2$→_{△}^{催化劑}$2
+O2$→_{△}^{催化劑}$2 +2H2O.
+2H2O.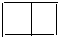 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com