
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
分析 氯化鐵與硫化氫發生反應:2Fe3++H2S=2Fe2++S↓+2H+,與Fe發生反應:2Fe3++Fe=3Fe2+,由于Fe過量,生成的鹽酸再和鐵反應生成氯化亞鐵,最終溶液為FeCl2溶液,最終溶液中0.6mol金屬離子為Fe2+,根據氯離子守恒計算n(FeCl3),進而計算其物質的量濃度.
解答 解:氯化鐵與硫化氫發生反應:2Fe3++H2S=2Fe2++S↓+2H+,與Fe發生反應:2Fe3++Fe=3Fe2+,由于Fe過量,生成的鹽酸再和鐵反應生成氯化亞鐵,最終溶液為FeCl2溶液,最終溶液中0.6mol金屬離子為Fe2+,
根據氯離子守恒:3n(FeCl3)=2n(FeCl2),即n(FeCl3)=$\frac{2}{3}$n(FeCl2)=0.6mol×$\frac{2}{3}$=0.4mol,
故原溶液中c(FeCl3)=$\frac{0.4mol}{0.1L}$=4mol/L,
故選B.
點評 本題考查混合物有關計算,明確發生的反應是解題關鍵,利用守恒法解答,避免方程式的繁瑣,側重考查學生分析計算能力,難度中等.


科目:高中化學 來源: 題型:解答題
 表示某粒子的結構示意圖.
表示某粒子的結構示意圖.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
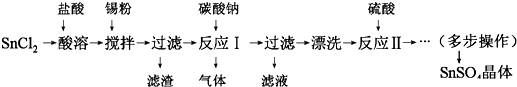
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
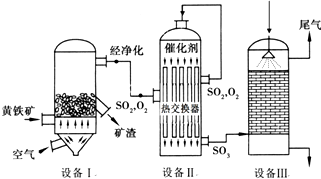
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

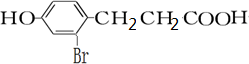 .
.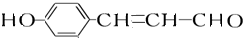 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$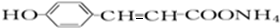 +2Ag↓+3NH3+H2O,反應類型為氧化反應.
+2Ag↓+3NH3+H2O,反應類型為氧化反應.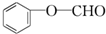 ,
,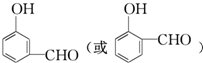 .
. +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 澄清的石灰水與稀鹽酸反應:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氫氧化鋇溶液與稀硫酸的反應:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蝕印刷電路板上銅箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸鈣溶于稀鹽酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
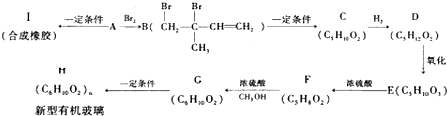
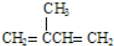 (不考慮立體異構),由G生成H的反應類型是加聚反應;
(不考慮立體異構),由G生成H的反應類型是加聚反應;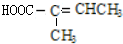 +CH3OH$→_{△}^{濃硫酸}$
+CH3OH$→_{△}^{濃硫酸}$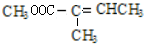 +H2O.與F具有相同官能團且比F少一個碳原子的有機物的同分異構體有3種(不考慮立體異構);
+H2O.與F具有相同官能團且比F少一個碳原子的有機物的同分異構體有3種(不考慮立體異構);查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com