
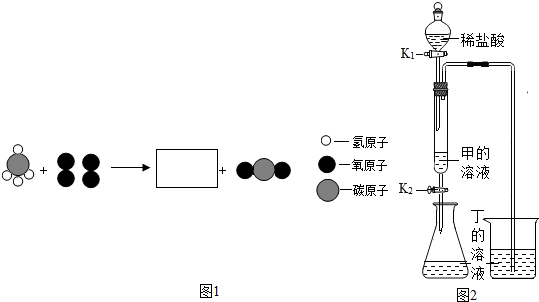
分析 (1)碳酸鈉俗稱純堿,寫出化學式;
(2)根據氧化鈣與水反應生成了氫氧化鈣能放出大量的熱分析回答;
(3)根據質量守恒定律反應前后原子的種類、數目不變分析;
(4)①根據二氧化碳能與氫氧化鈣反應生成了碳酸鈣沉淀和和水分析回答;
②根據鹽酸、碳酸鈉、氫氧化鈣的性質分析.
解答 解:(1)甲俗稱純堿,則甲為碳酸鈉,化學式為Na2CO3.
(2)由于氧化鈣與水反應生成了氫氧化鈣能放出大量的熱,氧化鈣是由鈣、氧兩種元素組成的,屬于氧化物,由此可知,乙的名稱是氧化鈣,檢驗其還有無干燥效果的化學原理是:CaO+H2O=Ca(OH)2.
(3)由物質的微觀構成可知,丙為甲烷,燃燒生成了二氧化碳和水,由質量守恒定律反應前后原子的種類、數目不變可知,在方框中補應補充兩個水分子,見下圖: ,方框中相應微粒的化學式為:H2O,該反應中丙與氧氣的質量比為(12+1×4):16×2=1:2..
,方框中相應微粒的化學式為:H2O,該反應中丙與氧氣的質量比為(12+1×4):16×2=1:2..
(4)①由于鹽酸與碳酸鈉反應生成的二氧化碳能使氫氧化鈣溶液變渾濁,氫氧化鈣是由上述中的元素組成的,所以,丁物質是氫氧化鈣,反應的方程式是:CO2+Ca(OH)2═CaCO3↓+H2O.
②由題意可知,取反應后錐形瓶中的溶液少許于試管中,加入少量氧化銅粉末,發現固體溶解,溶液變藍,說明溶液中有剩余的鹽酸,則碳酸鈉、氫氧化鈣完全反應,該溶液中含有的溶質除HCl外,還有鹽酸與碳酸鈉、氫氧化鈣生成的NaCl、CaCl2.
故答為:
(1)Na2CO3;
(2)CaO+H2O=Ca(OH)2;
(3)H2O; 1:2;
(4)①CO2+Ca(OH)2═CaCO3↓+H2O;②3.
點評 本題的推斷由組成物質的元素做為限定條件,因此,熟悉常見物質的組成、性質及變化規律對該題中所涉及物質的推斷就至關重要了.


科目:初中化學 來源: 題型:選擇題
| A. | 肯定大于6 mL | B. | 肯定小于6 mL | ||
| C. | 肯定等于6 mL | D. | 可能大于也可能小于6 mL |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 用氫氧化鈉溶液吸收二氧化碳:CO2+2NaOH═Na2CO3+H2O 復分解反應 | |
| B. | 溶洞的形成:CaCO3+H2O+CO2═Ca(HCO2)2 化合反應 | |
| C. | 實驗室制取氫氣:Fe+2HCl═FeCl2+H2 置換反應 | |
| D. | 用氫氧化鎂治療胃酸過多:Mg(OH)2+H2SO4═MgSO4+2H2O 中和反應 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
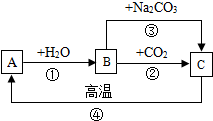 A、B、C是三種常見的含鈣化合物.它們之間有如圖所示的轉化關系(部分產物略去).
A、B、C是三種常見的含鈣化合物.它們之間有如圖所示的轉化關系(部分產物略去).查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
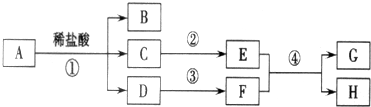
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
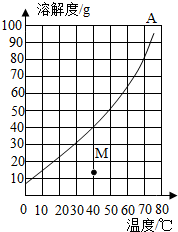 如圖是A物質的溶解度曲線圖,如表是B物質在不同溫度時的溶解度.
如圖是A物質的溶解度曲線圖,如表是B物質在不同溫度時的溶解度. | 溫度/℃ | 0 | 20 | 40 | 60 | 80 |
| B物質溶解度/g | 32 | 35 | 40 | 45 | 55 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com