
下列凈水方法中,凈化程度最高的是( )
|
| A. | 靜置 | B. | 過濾 | C. | 吸附 | D. | 蒸餾 |
| 水的凈化. | |
| 專題: | 空氣與水. |
| 分析: | 根據凈化水操作的原理及在凈化過程中所起到的作用,分析操作后水的組成,判斷其中凈化程度最高的方法. |
| 解答: | 解:A、靜置凈水時只能沉降掉較大的固體顆粒,所得水中還會含不可溶、可溶性雜質等; B、過濾可除去水中不溶性固體雜質,所得水還會含有可溶性雜質等; C、吸附可除去水中色素、有異味雜物、有毒雜質等,所得水仍含有其它雜質; D、蒸餾,把水通過蒸發、冷凝處理,處理后的水中只含水一種物質,所得水稱為蒸餾水為純凈物; 因此凈化程度最高的方法是蒸餾; 故選D. |
| 點評: | 熟悉常用的凈化水的方法所涉及的原理或變化,對于此問題的解答是必備的知識基礎. |


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
右圖是A、B、C三種物質的溶解度曲線。
 ⑴
⑴ t1℃時,溶解度最大的物質是 (填字母序號);
t1℃時,溶解度最大的物質是 (填字母序號);
⑵在t2℃時,把150g A物質的飽和溶液降溫到t1℃,析出晶體的質量為 g,此時所得溶液中溶質的質量分數為 ;
⑶用同一種方法可以使A、B、C三種物質的溶液都有晶體析出,該方法是 。
查看答案和解析>>
科目:初中化學 來源: 題型:
物質除雜是化學實 驗中經常遇到的問題。
驗中經常遇到的問題。
【方法探究】為除去二氧化碳氣體中混有的少量一氧化碳,小明設計了三種方案。
| 實驗方案 | |||||||
| 方案A[來源:學§科§網] |
| ||||||
| 方案B |
| ||||||
| 方案C |
|
上述方案中有兩個是合理的,寫出合理方案中任意一個反應的化學方程式 ;
【方法提煉】上述兩種合理方案體現了物質除雜的不同思路:
思路一:將雜質直接轉化為所需物質;
思路二:將所需物質轉化為中間物質,再將中間物質轉化為所需物質。
【方法運用】
運用思路一:除去氯化鎂粉末中混有的少量氯化鋇,先加足量的水溶解,再向溶液中加入適量的 溶液,過濾、蒸發,即得氯化鎂固體。
運用思路二:除去氯化鎂粉末中混有的少量氯化鋇、氯化鈉和硫酸鉀。
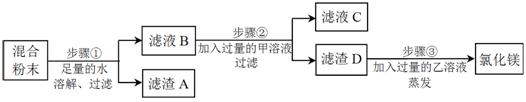
步驟①中反應的化學方程式是 ,濾液B中一定含有的溶質是 ;
步驟②中反應的化學方程式是 ,濾液C中一定含有的陰離子是 ;
步驟③中乙溶液是 (填化學式)溶液。
查看答案和解析>>
科目:初中化學 來源: 題型:
酸雨的危害很大,硫酸型酸雨的形成一有以下兩種途徑:
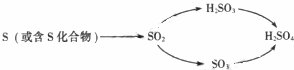
(1)正常雨水略顯酸性,主要原因是 .
(2)pH<5.6的降水稱為酸雨,它會使土壤酸化,施用適量 可改良土壤酸性.
(3)SO2通入碘水(I2的水溶液)會生成硫酸(H2SO4)和氫碘酸(HI),我們可利用此原理來測定空氣中SO2的含量.SO2的變化過程可表示為:SO2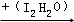 H2SO4
H2SO4
請寫出該反應的化學方程式: .
查看答案和解析>>
科目:初中化學 來源: 題型:
為了比較甲、乙兩種金屬的活動性強弱和相對原子質量大小,小吳設計了一套實驗裝置(如圖),他取兩種金屬(表面積相同)各m克,分別加入足量的稀硫酸(相同質量和質量分數)進行反應,在相同條件下測定不同時間內收集到的氣體體積,實驗記錄如下表:
| 反應時間(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的氣體體積(毫升) | 甲金屬 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金屬 | 30 | 75 | 120 | 150 | 150 | 150 | 150 |
(1)由實驗結果可知:金屬活動性較強的是 .
(2)為了使得到的實驗數據準確,小吳開始收集氣體的時間點應該是 .
A.導管口一有氣泡冒出時
B.冒出氣泡連續且均勻時
C.檢驗產生的氣體純凈時
(3)根據已有實驗數據,要比較甲、乙兩種金屬的相對原子質量大小,還需知道 .
A.參加反應的硫酸質量
B.生成物中金屬元素的化合價.

查看答案和解析>>
科目:初中化學 來源: 題型:
⑴人們常說:①高原上缺氧 ②生理鹽水 ③胃酸過多 ④發酵粉中的小蘇打。請用化學符號表示:
①中的“氧” ▲ ;②中的“鹽” ▲ ;③中的“酸” ▲ ;④中的小蘇打 ▲ 。
⑵在宏觀、微觀和符號之間建立聯系是化學學科的特點.
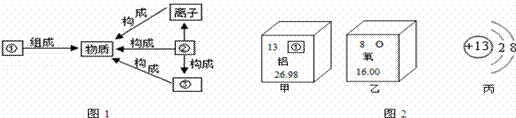
a.將“分子”、“原子”、“元素”填入如圖1序號所對應的橫線上.
① ▲ ;② ▲ 。
b.在銅、氯化鈉、二氧化碳三種物質中,由分子構成的是 ▲ 。
c.根據原子結構的相關知識和圖2的信息填空:甲圖中①代表的元素符號是 ▲ ,乙圖中所示元素原子的相對原子質量是 ▲ ,鋁和氧兩種元素形成化合物的化學式▲ ;丙圖所示粒子符號是 ▲ 。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com