
5. 下列對本文分析概括有誤的一項是( )(3分)
A.作者認為真正的賢能大臣是沒有閑暇建造別館供自己享樂的。
B.馮溥任職時雖沒什么大事值得稱贊,但其修建的“萬柳堂”卻為后人留下一處美景,作者對此予以充分肯定。
C.作者認為“士”應當有自己的追求,對于身外富貴不必羨慕。
D.本文由議論引出游歷“萬柳堂”一事,因“游”而“記”,借“記”而生發感慨,敘議結合,而遣詞造句極為精工。
4. 對下列句子中加點的詞的解釋,不正確的一項是( )(3分)
A.其在廷時無可訾 訾:非議
B.而榜其堂曰 榜:門上的匾
C.而累其土以成山 累:堆積
D.則好游者咸為予言此地之勝 勝:美景
2.下列推斷不符合原文意思的一項是(3分)
A.高新技術的發展,不可避免地會帶來負效應,人類對此必須有清醒的認識。
B.只有提高可靠性,減少產品機能開發,降低公害,才能克服高新技術的負效應。
C.文中所說的“巴洛克化”指的是各類高新技術產品的許多機能缺乏實用價值。
D.克服高新技術發展的負效應已成為高新技術發展過程中迫切需要解決的問題。
1.從第一段看,對文中“高新技術發展的負效應”一句的理解,最準確的一項是(3分)
A.高新技術竟然匹配不上工藝、監控、管理系統,讓科學家們覺得很尷尬。
B.高新技術發展中不可避免地產生各種風險事故,影響了高新技術的推廣。
C.戰爭、交通事故及醫療事故的發生,高新技術具有不可推卸的責任。
D.當今高新技術系統的抗御“災害”功能不夠健全使其在實施中出現危害。
2、巖漿晶出順序與晶格能的關系?
[投影] 巖漿:

[小結]晶格能越大,越早析出晶體。越早達到飽和,越易析出。
2、你認為什么因素決定了離子晶體中離子的配位數?利用相關數據計算,并填表:
|
ZnS |
NaCl |
CsCl |
|
r+/r-=0.2-0.4 |
r+/r-=0.52 |
r+/r-=0.93 |
|
C.N=4 |
C.N=6 |
C.N=8 |
[投影]探究練習參考資料:
|
離子 |
Na+ |
Cs+ |
Cl- |
|
離子半徑/pm |
95 |
169 |
18l |
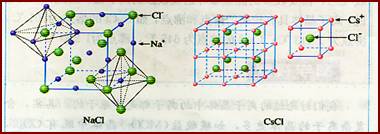
[講] 顯而易見,NaCl和CsCl是兩種不同類型的晶體結構。晶體中正負離子的半徑比(r+/r-)是決定離子晶體結構的重要因素,簡稱幾何因素。
[板書]4、配位數:與中心離子(或原子)直接成鍵的離子(或原子)稱為配位離子(原子)。
[講]配位離子的數目稱為配位數。
[板書]5、結構模型:
(1) 氯化鈉晶體
[投影]
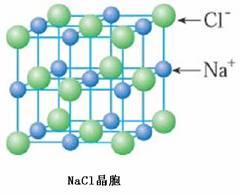
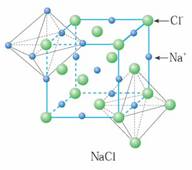
[講]由下圖氯化鈉晶體結構模型可得:每個Na+緊鄰6個Cl-,每個Cl-緊鄰6個Na+(上、下、左、右、前、后),這6個離子構成一個正八面體。設緊鄰的Na+與Cl-間的距離為a,每個Na+與12個Na+等距離緊鄰(同層4個、上層4個、下層4個)。由均攤法可得:該晶胞中所擁有的Na+數為4個 , Cl-數為4個,晶體中Na+數與Cl-數之比為1:1,則此晶胞中含有4個NaCl結構單元。
[板書](2)氯化銫晶體
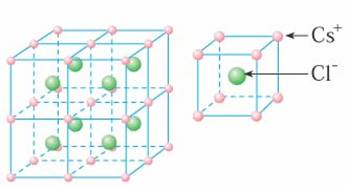
[講]每個Cs+緊鄰8個Cl-,每個Cl-緊鄰8個Cs+,這8個離子構成一個正立方體。設緊鄰的Cs+與Cs+間的距離為a,則每個Cs+與6個Cs+等距離緊鄰(上、下、左、右、前、后)。晶體中的Cs+與Cl-數之比為1:1。
[投影]

[講] 上面兩例中每種晶體的正負離子的配位數相同,是由于正負離子電荷(絕對值)相同,于是正負離子的個數相同,結果導致正負離子配位數相等,如在NaCl中,Na+擴和C1-的配位數均為6。如果正負離子的電荷不同,正負離子的個數必定不相同,結果,正負離子的配位數就不會相同。這種正負離子的電荷比也是決定離子晶體結構的重要因素,簡稱電荷因素。例如,在CaF2晶體中,Ca2+和F-的電荷比(絕對值)是2:l,Ca2+和F-的個數比是l:2,如圖3-29所示。Ca2+的配位數為8,F-的配位數為4。此外,離子晶體的結構類型還取決于離子鍵的純粹程度(簡稱鍵性因素)。
[投影]
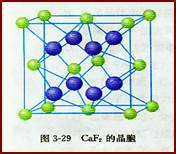
[板書]6、影響因素:
(1) 幾何因素:晶體中正負離子的半徑比(r+/r-)。
[講]離子鍵無飽和性和方向性,但成鍵時因離子半徑決定了陰陽離子參加成鍵的數目是有限的。陰陽離子半徑比值越大,配位數就越大。
[板書](2) 電荷因素:正負離子的電荷比。
(3) 鍵性因素:離子鍵的純粹程度。
[講] 在離子晶體中,離子間存在著較強的離子鍵,要克服離子間的相互作用使物質熔化和沸騰,就需要較多的能量。因此,離子晶體具有較高的熔點、沸點和難揮發的性質。
[板書]7、離子晶體特點:
(1) 較高的熔點和沸點,難揮發、難于壓縮。
[講]離子晶體的熔沸點,取決于構成晶體的陰陽離子間的離子鍵的強弱,而離子鍵的強弱,又可用離子半徑衡量,通常情況下,同種類型的離子晶體,離子半徑越小,離子鍵越強,熔沸點越高。
[講]離子晶體中,由于離子鍵的強烈作用,離子晶體表現出較高的硬度,當晶體受到沖擊力作用時,部分離子鍵發生斷裂,導致晶體破碎。
[板書] (2) 硬而脆,無延展性
[講]離子晶體中陰陽離子交替出現,層與層之間如果滑動,同性離子相鄰而使斥力增大導致不穩定,所以離子晶體無延展性。
[講]由于離子晶體中離子鍵作用較強,離子晶體不能自由移動,即晶體中無自由移動離子,因此,離子晶體不導電。當升高溫度時,陰陽離子獲得足夠能量克服了離子間相互作用,成為自由移動的離子,在外界電場作用下,離子定向移動而導電。離子化合物溶于水時,陰陽離子受到水分子作用變成了自由移動的離子(或水合離子),在外界電場作用下,陰陽離子定向移動而導電。
[板書] (3) 不導電,但熔化后或溶于水后能導電。
[講]當把離子晶體放在水中時,極性水分子對離子晶體中的離子產生吸引,使晶體中的離子克服離子間的作用而離開晶體,變成在水中自由移動的離子。
[板書](4) 大多數離子晶體易溶于極性溶劑中,難溶于非極性溶劑中。
[小結]化學變化過程一定發生舊化學鍵的斷裂和新化學鍵的形成,但破壞化學鍵或形成化學鍵的過程卻不一定發生化學變化。
[自學]科學視野-復雜離子的晶體
碳酸鹽在一定溫度下會發生分解,如大家熟悉的碳酸鈣煅燒得到石灰(CaO),這是由于碳酸鈣受熱,晶體中的碳酸根離子會發生分解,放出二氧化碳。實驗證明,碳酸鹽的陽離子不同,熱分解的溫度不同。
|
碳酸鹽 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
熱分解溫度/℃ |
402 |
900 |
1 172 |
1 360 |
|
陽離子半徑/pm |
66 |
99 |
112 |
135 |

教 案
|
課題:第四節 離子晶體(2) |
授課班級 |
|
|||||||||
|
課 時 |
|
||||||||||
|
教 學 目 的 |
知識 與 技能 |
理解離子晶體的晶格能與性質的關系。 |
|||||||||
|
過程 與 方法 |
|
||||||||||
|
情感 態度 價值觀 |
|
||||||||||
|
重 點 |
離子晶體的晶格能與性質的關系。 |
||||||||||
|
難 點 |
離子晶體的晶格能與性質的關系。 |
||||||||||
|
知 識 結 構 與 板 書 設 計 |
二、晶格能 1、定義:晶格能是指1mol的離子化合物中的陰陽離子,由相互遠離的氣態,結合成離子晶體時所釋放出的能量或拆開1mol離子晶體使之形成氣態陰離子和陽離子所吸收的能量。單位是kJ/mol 2、影響因素:離子的電荷和陰陽離子的大小。 3、規律:晶格能越大,形成的離子晶體越穩定,而且熔點越高,硬度越大。 |
||||||||||
|
教學過程 |
|||||||||||
|
教學步驟、內容 |
教學方法、手段、師生活動 |
||||||||||
|
[講] 最能反映離子晶體穩定性的數據是它們的晶格能。離子晶體的品格能的定義是氣態離子形成l摩離子晶體釋放的能量,通常取正值,表3-8給出了某些離子晶體的晶格能數據。 [板書]二、晶格能 1、定義:晶格能是指1mol的離子化合物中的陰陽離子,由相互遠離的氣態,結合成離子晶體時所釋放出的能量或拆開1mol離子晶體使之形成氣態陰離子和陽離子所吸收的能量。單位是kJ/mol [投影]
[板書] 2、影響因素:離子的電荷和陰陽離子的大小。 [講]晶格能與離子電荷的乘積成正比,與陰陽離子的大小成反比。 [觀察] 分析晶格能大小與晶體穩定性關系。 [講]晶格能的數據可以用來說明許多典型的離子晶體的物理化學性質的變化規律。 [板書]3、規律:晶格能越大,形成的離子晶體越穩定,而且熔點越高,硬度越大。 [自學]科學視野-巖漿晶出規則與晶格能 [問題]1、什么是巖漿晶出? 3、可得用X射線衍射儀鑒別。 |
|
||||||||||
|
教學回顧: |
|||||||||||
教 案
|
課題:第三章 第一節 晶體常識(2) |
授課班級 |
|
|||||
|
課 時 |
|
||||||
|
教 學 目 的 |
知識 與 技能 |
掌握晶體與晶胞的關系、會通過晶胞確定晶體的化學式 |
|||||
|
過程 與 方法 |
學會判斷晶體的化學式以及計算晶胞中所含的微粒數目的方法,提高邏輯思維能力和空間想象能力 |
||||||
|
情感 態度 價值觀 |
了解人類探索物質結構的價值,認同“物質結構的探索是無止境的”觀點,認識在分子等層次研究物質的意義。 |
||||||
|
重 點 |
通過晶胞確定晶體的化學式 |
||||||
|
難 點 |
晶胞的結構 |
||||||
|
知 識 結 構 與 板 書 設 計 |
二、晶胞 1、晶胞:描述晶體結構的基本單元。 2、晶胞中原子占有率:頂點:1/8;邊心:1/4;面心:1/2;體心:1。 3、三種典型的立方晶體結構 |
||||||
|
教學過程 |
|||||||
|
教學步驟、內容 |
教學方法、手段、師生活動 |
||||||
[投影]蜂巢、銅晶體及銅晶胞模型: [講]為了描述晶體在微觀空間里原子的排列,無須畫出千千萬萬個原子,只需在晶體微觀空間里取出一個基本單元即可。這種描述晶體結構的基本單元叫做晶胞。可用蜂巢和蜂室的關系比喻晶體和晶胞的關系。 [板書]二、晶胞 1、晶胞:描述晶體結構的基本單元。 [講]銅晶體的排列方式:整塊晶體可以看作是數量巨大的晶胞“無隙并置”而成;所謂“無隙”,是指相鄰晶胞之間沒有任何間隙;所謂“并置”,是指所有晶胞都是平行排列的,取向相同。 [設問]銅晶胞含有4個銅原子,為什么不是14個? [講] 我們在觀察晶胞圖時,千萬不能忘記,晶胞只是晶體微觀空間里的一個基本單元,在它的上下左右前后無隙并置地排列著無數晶胞,而且所有晶胞的形狀及其內部的原子種類、個數及幾何排列是完全相同的。因而,晶胞的頂角原子是8個晶胞共用的,晶胞棱上的原子是4個晶胞共用的,晶胞面上的原于是兩個晶胞共用的。 [投影]3-8學生探究晶胞占有原子的規律: 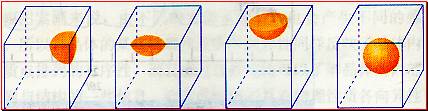 [板書]2、晶胞中原子占有率:頂點:1/8;邊心:1/4;面心:1/2;體心:1。 [講]非長方體形晶胞中粒子對晶胞的貢獻視具體情況而定的。如石墨晶胞第一層內碳原子排成六邊形,其頂點(1個碳原子)對六邊形的貢獻為1/3 [投影探究] 圖3-9依次是金屬鈉(Na)、金屬鋅(Zn)、碘(12)、金剛石(C)晶胞的示意圖,數一數,它們分別平均含幾個原子? 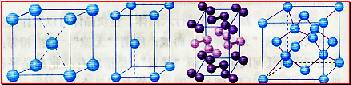 [投影]鈉、鋅晶胞都是:8×1/8+1=2;碘:(8×1/8+6×1/2)×2=8;金剛石:8×1/8+6×1/2+4=8。 [思考]上述銅晶體、金剛石、CO2晶體、NaCl晶體的晶胞的空間構型呈什么形狀?在上述晶體中,晶胞是如何排列的?晶胞之間是否有空隙? [板書]3、三種典型的立方晶體結構: [講](1)六方晶胞:在六方體頂點的微粒為6個晶胞共有,在面心的為2個晶胞共有,在體內的微粒全屬于該晶胞。微粒數為:12×1/6 + 2×1/2 + 3 = 6 (2)面心立方:在立方體頂點的微粒為8個晶胞共有,在面心的為2個晶胞共有。微粒數為:8×1/8 + 6×1/2 = 4 (3)體心立方:在立方體頂點的微粒為8個晶胞共享,處于體心的金屬原子全部屬于該晶胞。微粒數為:8×1/8 + 1 = 2 [投影小結] 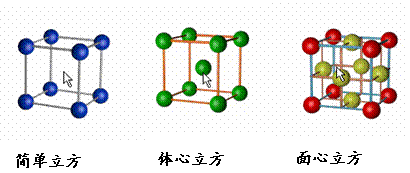  [隨堂練習] 1、現有甲、乙、丙、丁四種晶胞如下圖所示,可推知:甲晶體中A與B的離子個數比為 ;乙晶體的化學式為 ;丙晶體的化學式為______;丁晶體的化學式為___ ___。 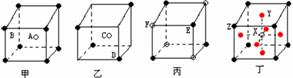 2、下圖依次是金屬鈉(Na)、金屬鋅(Zn)、碘(12)、金剛石(C)晶胞的示意圖,數一數,它們分別平均含幾個原子? 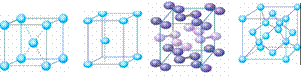  3、鈣-鈦礦晶胞結構如右圖所示。觀察鈣-鈦礦晶胞結構,求該晶體中,鈣、鈦、氧的微粒個數比為多少? 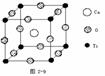 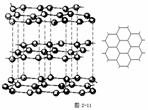 4、在碳單質的成員中還有一種混合型晶體--石墨,如圖所示。它是層狀結構,層與層之間依靠作用力相結合。每層內部碳原子與碳原子之間靠作用力相結合,其鍵角為120ْ。分析圖中每個六邊形含有 個碳原子。 4、在碳單質的成員中還有一種混合型晶體--石墨,如圖所示。它是層狀結構,層與層之間依靠作用力相結合。每層內部碳原子與碳原子之間靠作用力相結合,其鍵角為120ْ。分析圖中每個六邊形含有 個碳原子。5、右圖是NaCl晶胞示意圖,晶胞中Na+和Cl¯的個數比是多少? 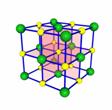 6、右圖是CO2分子晶體的晶胞結構示意圖,其中有多少個原子? 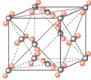 |
|
||||||
|
教學回顧: |
|||||||
2、可得用寶石的折光率鑒別。
2、利用晶體與非晶體的性質差別來鑒別玻璃和寶石。寶石是晶體,具有固定的熔點和各向異性,可用硬度、熔點、折光率等性質來鑒別寶石。
[投影]1、可觀察寶石的形狀,具有多面體的外形,實驗它的硬度,可在玻璃上劃出痕跡,初步確定它是晶體。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com