
第九單元 溶液
課題1溶液的形成
目的要求:1. 認識溶解現象,知道溶液、溶劑、溶質等概念。
2. 探究幾種物質在水中溶解時溶液的溫度變化。
3. 知道一些常見的乳化現象。
4. 知道溶液是一類重要的物質,在生產和生活中有重要應用。
5. 學習科學探究和科學實驗的方法,練習觀察、記錄、分析實驗現象
重點:溶液、溶質、溶劑的概念。
難點:物質在水中溶解溶液溫度變化的實質
教學過程:
1.在上課前,教師應了解學生有哪些有關溶液的知識,盡量從學生熟悉的事物引入。本章的章圖及圖9-1為引入溶液的教學提供了廣闊的空間,教師可以充分利用。
2.【實驗9-1】對于溶液的基本特征,要抓住均一性和穩定性。所謂均一,是指溶液各處都完全一樣;所謂穩定,是指條件不變時溶質和溶劑長期不會分離。但要注意,這是指溶液形成以后,而不是指在溶解過程中。在蔗糖溶解過程中,杯底部溶液當然要濃一些,上層要稀一些,但這僅僅是分子擴散尚未達成均一時的情況,形成溶液后,各處就一樣了。另外,還應啟發學生多從微觀的角度去想象,分散在溶劑中的分子或離子達到均一狀態之后,仍然處于不停的無規則運動狀態之中。
3.對于溶液的廣泛用途,學生有許多生活經驗,要通過討論促使學生積極思考,并體會化學對生活和生產的作用。在討論中,如學生提出了獨特的見解,教師應予以鼓勵。
4.“乳化”現象是通過實驗引出的,學生也有這方面的生活經驗。洗滌劑是一種最常見的乳化劑。應該注意的是,“乳化”并不是溶解,只是使植物油分散成無數細小的液滴存在于水中,而不聚集成大的油珠,這與物質溶解在水中是完全不同的。對于溶液和乳濁液,只從定性的角度描述它們的特征,沒有提出分散質顆粒直徑大小的問題,因此是一種粗略的說法。
.溶液、溶質、溶劑
一種或幾種物質分散到另一種物質里,形成均一的、穩定的混合物,叫做溶液(實質上溶質分散在溶劑中的粒子的線性直徑小于1 nm);被分散的物質叫做溶質;能分散其他物質的物質叫溶劑。
對溶液的認識要注意以下幾點:
①溶質在被分散前的狀態可以是固體、液體、氣體。
②某溶液中溶質或溶劑的種類可以是一種,也可以是兩種或兩種以上;在初中階段討論的溶液中溶質或溶劑的種類一般是一種。
③水是最常用的溶劑,酒精(乙醇)、汽油等物質也可以作溶劑,當溶液中有水存在時,不論水的量有多少,習慣上把水看作溶劑,通常不指明溶劑的溶液,一般指的是水溶液。溶液不一定都是無色的,其顏色由溶質、溶劑的性質而決定。
④溶液的質量等于溶質、溶劑的質量之和(溶質的質量是指被分散的那部分物質的質量,沒有分散進溶劑內的物質,就不能計算在內)。溶液體積不一定等于溶質和溶劑體積之和,如100 mL酒精和100 mL水混合后體積小于200 mL。這是因為分子間有間隔的緣故。
2.溶液的特征:均一性、穩定性
均一性:是指溶液各部分的溶質濃度和性質都相同。但溶液中分散在溶劑中的分子或離子達到均一狀態之后,仍然處于不停地無規則運動狀態之中。
穩定性:是指外界條件(溫度、壓強等)不變時,溶液長期放置不會分層,也不會析出固體或放出氣體。
一:溶液
利用燒杯和玻璃棒,分別取少量面粉、植物油、食鹽、蔗糖、味精、純堿、酒精、粉筆灰、泥土等物質加入水中并攪拌,將觀察到的現象填入下表的空格處。
(1)比較溶液、懸濁液或乳濁液中物質能否被水溶解。
(2)溶液與懸濁液、乳濁液在外觀上有何不同?
1:幾種物質在水中的分散現象(有現象的打√)
物質名稱
實 驗 現 象
溶解
外觀透明
均一
穩定
不溶解
外觀混濁
不均一
不穩定
純堿
√
√
√
√
食鹽
味精
酒精
面粉
粉筆
汽油
植物油
結論
形成的混合物屬溶液
形成的混合物是懸濁液或乳濁液
2:比較碘和高錳酸鉀溶于水或汽油中的現象
溶劑
溶質
現象
水
高錳酸鉀
水
碘
汽油
高錳酸鉀
汽油
碘
3:溶液與懸濁液、乳濁液有何本質區別?
溶液
懸濁液
乳濁液
分散物質原來的狀態
固、液、氣
固
液
分散在水里的粒子
分子或離子
許多分子的集合體
許多分子的集合體
特征
均一、穩定
不均一、不穩定
不均一、不穩定
實例
食鹽水、糖水
泥漿
乳白魚肝油
一種或幾種以上的物質高度分散(以分子、離子或原子)到另一種物質里,形成均一的、穩定的混合物叫做溶液。我們把能溶解其他物質的物質叫溶劑;被溶解的物質叫溶質。通常所說的溶液指的是液態溶液。
同學們要掌握和理解溶液定義中所包含的三層意義:
第一,均一和穩定是溶液的特征。
第二,分散兩字體現溶液的形成。
第三,溶液是混合物,它由溶質和溶劑組成,即一種或一種以上的物質叫做溶質,另一種物質叫做溶劑。
根據溶液的聚集態,可分為固態溶液(簡稱固溶體,如某些成分的合金等);液態溶液(簡稱溶液,如食鹽水、碘酒等);氣態溶液(亦稱氣溶體或氣體混合物,如空氣等)。通常所說的溶液,其中最常見的是水溶液。
問題:如果在水中滴入數滴洗潔精或涂些肥皂,這時清除油跡就比較容易,這是什么原因呢?
實驗:在一只玻璃杯或瓷碗中加入約10 mL水,用筷子蘸食用油滴入數滴,觀察現象;振蕩片刻,靜置一段時間,觀察實驗現象。然后向其中加入幾滴洗潔精或肥皂水,振蕩片刻,再靜置一段時間,觀察這次的實驗現象跟上一次的有何不同。
閱讀課本,看一看書上是怎樣解釋“乳化”的,然后試著解釋衣服、餐具上的油污可以用加入洗滌劑的水洗掉的原因
二:溶解時的吸熱和放熱現象
物質的溶解(活動與探究)
水中加入的溶質
NaNO3
NH4 NO3
NaOH
加入溶質前水的溫度
溶解現象
溶質溶解后的溫度
結論
什么是溶解
一種物質(溶質)均勻地分散在另一種物質(溶劑)中形成溶液的過程叫溶解。
溶解是一種物理化學過程,包含物理的機械擴散和化學的溶劑化。一種物質(溶質)溶解于溶劑中,常有熱效應發生(吸熱或放熱)。例如氫氧化鈉溶解于水中時放熱,硝酸銨溶于水中要從環境中吸收熱量。兩種液體互溶時,液體的總體積可能縮小(如酒精跟水互溶),也可能增大(如苯跟醋酸互溶),或可能基本不變(如正己烷和正庚烷互溶)
溶質分散到溶劑中形成溶液的過程,叫做物質的溶解。在物質溶解形成溶液的過程中,所發生的溶質的分子(或離子)向溶劑中擴散的過程吸收熱量,而溶質的分子(或離子)與溶劑作用生成溶劑合物的過程放出熱量,所以物質溶解通常伴隨著熱量的變化。
課題2 溶解度
目的要求:1.了解飽和溶液的涵義。掌握飽和溶液與不飽和溶液相互轉化的外界條件。
2.了解溶解度的涵義,初步學習繪制和查閱溶解度曲線。
重點:溶解度的概念,固體溶解度曲線的含義與應用
難點:溶解度的概念,固體溶解度曲線的含義與應用
教學過程:
[引言]通過前面的學習我們已經知道,酒精可以任意比例與水互溶,那么,在一定溫度下,一定量的溶劑所能溶解的溶質的質量有沒有一個限度呢?我們用什么方法來表示這種限度呢?
一:飽和溶液
活動與探究
操作
現象
結論
加
入
氯
化
鈉
加入5g食鹽、攪拌
再加入5g食鹽、攪拌
再加入5ml水、攪拌
在
水
中
加
入
硝
酸
鉀
加入5g硝酸鉀、攪拌
再加入5g硝酸鉀、攪拌
加熱
再加入5g硝酸鉀、攪拌
冷卻
1.飽和溶液:在一定溫度下,在一定量的溶劑里,不能再溶解某種溶質的溶液叫做這種溶質的飽和溶液。
2.不飽和溶液:在一定溫度下,在一定量的溶劑里,還能繼續溶解某種溶質的溶液,叫做這種溶質的不飽和溶液。
講述〕在講飽和溶液和不飽和溶液時,為什么要指明“一定溫度”和“一定量溶劑”呢?
在升高溫度或增加溶劑的量的情況下,原來的飽和溶液可以變成不飽和溶液。因此只有指明“在一定溫度下”和“一定量溶劑里”,溶液的“飽和”或“不飽和”才有確定的意義。
加熱(硝酸鉀晶體溶解)
 硝酸鉀飽和溶液 硝酸鉀不飽和溶液
硝酸鉀飽和溶液 硝酸鉀不飽和溶液
降溫(硝酸鉀晶體折出)
加水(氯化鈉固體溶解)
 氯化鈉飽和溶液 氯化鈉不飽和溶液
氯化鈉飽和溶液 氯化鈉不飽和溶液
蒸發溶劑(氯化鈉固體折出)
定性特征,一般說,要確定某一溶液是否飽和,只要看在一定溫度下,有沒有不能繼續溶解的剩余溶質存在,如有,且溶質的量不再減少,那么這種溶液就是飽和溶液。
〔練習〕現有一瓶接近飽和的硝酸鉀溶液,試舉出使它變成飽和溶液的方法。

增加溶質或降低溫度
 不飽和溶液 飽和溶液
不飽和溶液 飽和溶液
增加溶劑或升高溫度
總之:利用改變“溫度”或改變“溶質”或“溶劑”相對量的方法。
〔講述〕為了粗略地表示溶液里溶質含量的多少,人們還常常把溶液分成濃溶液和稀溶液。飽和溶液是否一定是濃溶液,而不飽和溶液是否一定是稀溶液呢?
結論:濃溶液不一定是飽和溶液,稀溶液也不一定是不飽和溶液。同一種溶質的溶液,在一定溫度下,飽和溶液比不飽和溶液要濃。
我們已經知道,物質在水中有的是可溶的,有的是不溶的。那么,對于可溶物質來說,[教師邊講邊板書以下兩個問題]
(l)溶質在一定條件(溫度一定、溶劑的量一定)下,能否無限制地溶解呢?
(2)不同溶質,在相同條件(溫度相同、溶劑的量相同)下,溶解的量是否相同?
以上兩個問題,請同學們先進行討論,提出實驗方法,然后通過實驗得出結論。
[學生進行討論,教師巡視,不時地參加同學間的議論]
生丙:溶質不能無限制地溶解在水里。實驗的方法是:取一定量的水,把溶質(可以用食鹽)加到水中,觀察它是不是無限制地溶解。
生辛:要保持一定的溫度,才能夠滿足第一個問題中所需要的條件。
師:對。要注意條件。我們可以取室溫下的一定體積的水,進行實驗。那么,怎樣證明在一定條件(溫度相同、溶劑的量相同)下,不同溶質溶解的量是否相同呢?
生丁:可以把不同的溶質,分別加到相同溫度、相同質量的水中,比較它們溶解的量是不是相同。
生戊:應該先稱量出相同質量的不同溶質的質量,然后把它們分別溶解在相同溫度、相同質量的水中,就可以比較它們溶解的量是不是相同。
師:根據大家的意見,我們可做一個對比實驗,同時說明以上兩個問題。即:稱量兩種(硝酸鉀和硝酸銨)不同溶質的質量(各20g),分別加入到相同溫度(室溫)、相同體積(10mL水)的水中,觀察溶質在一定條件下,能否無限制地溶解;同時比較兩種溶質溶解的質量是否相同。但是,怎樣判斷溶質在溶劑中是否能繼續溶解呢?
生丙:把溶質加入溶劑中,經攪拌或振蕩后,有剩余的固體時,說明溶質不能再溶解了。
師:回答得很好。那么,應該怎樣操作呢?是把溶質全部加入到溶劑中,還是要分數次,逐漸加入呢?
生[齊]:分數次,逐漸加入。
下面,請同學再考慮一個問題:通常人們根據溶液中含溶質的多少,把溶液分為“濃溶液”和“稀溶液”。今天我們又學習了“飽和溶液和不飽和溶液”,它們之間有什么聯系和區別?有人說:飽和溶液一定是濃溶液,不飽和溶液一定是稀溶液。這種說法是否正確?下面大家先討論,然后再回答。[學生進行討論,教師巡視,不時參加學生的討論]
生甲:飽和溶液不一定是濃溶液。例如,上面實驗中得到的硝酸鉀溶液和硝酸銨溶液都是飽和溶液,但是硝酸銨溶液中含溶質多、濃度大。而硝酸鉀溶液中含溶質少。濃度小。因此這兩種溶液相比較,硝酸銨是濃溶液,硝酸鉀是稀溶液。
師:回答得很好。對于不同溶質來說,飽和溶液不一定是濃溶液,不飽和溶液也不一定是稀溶液。對于同一種溶質來說,飽和溶液和濃溶液,不飽和溶液和稀溶液有什么關系呢?
生乙:對于同一種溶質的溶液,在同一溫度時,飽和溶液是濃溶液,不飽和溶液是稀溶液。
師:請你舉例說明。
生乙:例如,上面實驗中,開始加入少量硝酸鉀時,得到的是硝酸鉀的不飽和溶液;最后制得的是硝酸鉀飽和溶液。這兩種溶液相比較,不飽和溶液含溶質少,是稀溶液;飽和溶液含溶質多,是濃溶液。
師:[小結]今天我們通過實驗和討論,學習了飽和溶液和不飽和溶液、物質的溶解性,以及飽和溶液和濃溶液、不飽和溶液和稀溶液之間的區別和聯系等概念。這些概念為我們學習“固體物質的溶解度”打下基礎。課后,請同學們預習“固體物質的溶解度”。
二:溶解度
學生雖然對于一般物質溶解后形成溶液的現象比較熟悉,但是對從定量的角度去認識物質的溶解性以及溶液的種種狀態卻很少思考。在上一課題中,己從定性的角度研究了溶質放到溶劑中時的一些情況。但是不是所有物質都能溶解于水呢?在一定量水中是不是能大量溶解某一物質呢?本課題就要研究物質在一定量水中溶解的限度的問題。
問:不同物質在水中溶解能力是否相同?舉例說明。
答:不同。例如食鹽能溶于水,而沙子卻極難溶于水。
問:那么,同種物質在不同溶劑中溶解能力是否相同?
答:不同。例如油易溶于汽油而難溶于水。
教師總結: 物質溶解能力不僅與溶質有關,也與溶劑性質有關。通常我們將 一種物質在另一種物質中的溶解能力叫溶解性。
影響溶解度的外因
自然界中的某些現象都跟物質的溶解度有關。請根據下列事實推測外界因素如何影響物質的溶解度。
(1) 1999年我國科考隊首次在西藏羌北無人區發現,當地進入嚴冬時,廣大冰凍湖泊中析出十分壯觀的多面體的碳酸鈉晶體。
(2)夏天,貯存自來水的瓶子內壁掛滿一層氣泡。
(3)打開汽水瓶蓋時,常常有大量氣泡涌出。
(4)利用蒸發的方法從海水中提取食鹽。
1.:固體物質的溶解度
【提問】閱讀教材中有關溶解度的定義,影響固體物質溶解度的定義有哪幾個方面的因素?
(回答略。)
【講解】固體物質在某一種溶劑里的溶解度,涉及一定溫度、100g溶劑、達到飽和溶液和溶解的溶質克數四個因素。
以下四句話錯在哪里?
1.l00g水中最多溶解38g氯化鈉,所以氯化鈉在水中的溶解度是38g。
2.在10℃時,燒杯內水中最多溶有140g硝酸銨,所以硝酸銨在水中的溶解度是140g。
3.在60℃,100g水中溶有75g硝酸鉀,所以60℃時硝酸鉀的溶解度為75g。
4.60℃,100g水中最多溶解124g硝酸鉀,所以硝酸鉀在這溫度下的溶解度是124。
【討論】學生討論、辨析、糾正錯誤,認識固體物質溶解度的完整意義。
關鍵詞:一定溫度(指條件);100 g溶劑;飽和溶液;克(單位)。
[布置討論題]“20 ℃時食鹽溶解度是36 g”的含義是什么?
2.溶解度曲線
[講解]在平面直角坐標系中溶解度的大小與溫度有關。可以以橫坐標表示溫度,以縱坐標表示溶解度,畫出物質的溶解度隨溫度變化的曲線,這種曲線叫做溶解度曲線。
[板書]溶解度隨溫度變化的曲線叫做溶解度曲線。 [
展示教學掛圖]
問:影響固體溶解度的主要因素是什么?表現在哪些方面?
答:溫度。大多數固體溶解度隨溫度升高而增大,例如硝酸鈉;少數固體 溶解度受溫度影響不大,例如氯化鈉;極少數固體隨溫度升高溶解度反而減小,例如氫氧化鈣。
[布置學生討論]從溶解度曲線中我們可以獲取什么信息?
歸納:
a:溶解度曲線從溶解度曲線中可以查到有關物質在一定溫度下的溶解度;可以比較相同溫度下不同物質的溶解度以及各物質溶解度隨溫度變化的趨勢等等。
B:從溶解度曲線可以看出,大多數固體物質的溶解度隨溫度的升高而增大,如硝酸銨、硝酸鉀等;有些與溫度的變化關系不大,如氯化鈉。利用溶解度曲線提供的信息,可以對某些物質組成的混合物進行分離。
[講解]對大多數物質來說,其溶解度都是隨溫度的升高而增大的,也有些固體物質,其溶解度是隨著溫度的升高而減小,氫氧化鈣就是這樣一種物質。
[展示教學掛圖]氫氧化鈣溶解度曲線
[板書]氣體的溶解度:
通常用“1體積水中所能溶解氣體的體積”來表示氣體的溶解度。
氣體的溶解度隨溫度的升高而減小,隨壓強的升高而增大。
[擴展資料]
固體物質的溶解度
1.概念在一定溫度下,某固態物質在100g溶劑里達到飽和狀態時所溶解的質量,叫做這種物質在這種溶劑里的溶解度。如果不指明溶劑,通常所說的溶解度是指物質在水里的溶解度。例如,NaCl在20℃的溶解度為36g,表示的意義就是:在20℃時,100g水中溶解36g氯化鈉時溶液達到飽和狀態。或者說,在20℃時,100g水最多能溶解36g氯化鈉。
2.在理解固體溶解度概念時,要抓住的四個要點①“在一定溫度下”:因為每種固體物質的溶解度在一定溫度下有一個對應的值,或者說固體物質的溶解度隨溫度變化而變化。所以給出某固體物質的溶解度時,必須標明溫度。②“在100g溶劑里”:溶解度的概念中,規定溶劑的質量為100g。③“飽和狀態”:所謂飽和狀態,可以理解為在一定溫度下,在100g溶劑里,溶質的溶解量的最大值。④“所溶解的質量”:表明溶解度的單位是“克”。
3.影響溶解度的因素①溶質的性質;②溶劑的性質(見溶解性部分);③溫度。在溶質和溶劑一定的情況下,溫度是影響固體溶解度的重要因素。一般規律如下:大部分固體物質的溶解度隨著溫度的升高而增大(如硝酸鉀);少數固體物質的溶解度受溫度變化影響較小(如氯化鈉);極少數固體物質的溶解度隨著溫度的升高而減小(如氫氧化鈣)。
4.溶解度的表示方法溶解度隨溫度變化有兩種表示方法:①列表法;②溶解度曲線。
氣體物質的溶解度
氣體溶解度是指該氣體在壓強為101kPa,一定溫度時溶解在1體積水里達到飽和狀態時的氣體體積。例如在0℃時,氧氣的溶解度為0.049,就是指在0℃,氧氣壓強為101kPa時,1體積水最多能溶解0.049體積氧氣。
氣體溶解度與溫度和壓強有關,隨溫度升高而減小,隨壓強增大而增大。
溶解度曲線
1.溶解度曲線由于固體物質的溶解度隨溫度變化而變化,隨溫度一定而一定,這種變化可以用溶解度曲線來表示。我們用縱坐標表示溶解度,橫坐標表示溫度,繪出固體物質的溶解度隨溫度變化的曲線,這種曲線叫做溶解度曲線。
2.溶解度曲線的意義①表示同一種物質在不同溫度時的溶解度;③表示不同物質在同一溫度時的溶解度,可以比較同一溫度時,不同物質的溶解度的大小。若兩種物質的溶解度曲線相交,則在該溫度下兩種物質的溶解度相等;③根據溶解度曲線可以確定從飽和溶液中析出晶體或進行混合物分離提純的方法;④根據溶解度曲線能進行有關的計算。
溶解度曲線知識歸納
一、點的意義
1.溶解度曲線上的點表示物質在該點所示溫度下的溶解度,溶液所處的狀態是飽和溶液。
2.溶解度曲線下面的面積上的點,表示溶液所處的狀態是不飽和狀態,依其數據配制的溶液為對應溫度時的不飽和溶液。
3.溶解度曲線上面的面積上的點,依其數據配制的溶液為對應溫度時的飽和溶液,且該溶質有剩余。
4.兩條溶解度曲線的交點,表示在該點所示的溫度下,兩種物質的溶解度相等。
二、變化規律
1.大多數固體物質的溶解度隨溫度升高而增大,曲線為"陡升型",如硝酸鉀。
2.少數固體物質的溶解度受溫度的影響很小,曲線為"緩升型",如氯化鈉。
3.極少數固體物質的溶解度隨溫度的升高而減小,曲線為"下降型",如氫氧化鈣。
4.氣體物質的溶解度均隨溫度的升高而減小(縱坐標表示體積),曲線也為"下降型",如氧氣。
三、應用
1.查找指定溫度時物質的溶解度,并根據溶解度判斷溶解性。
2.比較相同溫度時(或一定濕度范圍內)不同物質溶解度的大小。
3.比較和確定物質的溶解度受溫度影響的程度,并據此確定物質結晶或混合物分離提純的方法。
4.確定溶液的狀態(飽和與不飽和)。
[探究活動]
1.下表列出一些物質在不同溫度下的溶解度。請你根據表中數據,在圖中畫出這兩種物質的曲線。
物質
0℃
20℃
40℃
60℃
80℃
100℃
硝酸鉀
13.3
31.6
63.9
110
169
246
氯化鈉
36
36
36
37
39
40
2.現有10g硝酸鉀和2g食鹽的混合物,如何將它們分離開?
實驗內容
可行性論證
實驗記錄
結 論
3:溶解度與溶解性
溶解度
>10克
>1克
<1克
<0.01克
溶解性
易溶
可溶
微溶
難溶(不溶)
課題3 溶質的質量分數
教學目的:1.掌握一種溶液組成的表示方法――溶質的質量分數,能進行溶質質量分數的簡單計算。
2.初步學會配制一定溶質質量分數的溶液。
重點:有關溶液中溶質的質量分數的計算。
難點:溶質的質量分數的計算中,涉及溶液體積時的計算
教學過程:
1.教材從配制三種組成不同的硫酸銅溶液的實驗入手,引導學生觀察和思考,并根據溶液的顏色深淺區分有色溶液是濃還是稀。在這個基礎上來闡明溶液組成的含義,使感性認識上升到理性認識,學生容易接受。接著介紹了一種表示溶液組成的方法,提出一個關系式,并讓學生以實驗中配制的三種溶液為例,通過簡單計算,鞏固對溶質的質量分數的認識。
2.在建立溶質的質量分數的概念之后,應讓學生了解,化學計算不等于純數學計算,在計算時要依據化學概念,要尊重化學事實,明確溶液的組成是指溶質在溶解度范圍內,溶液各成分在量方面的關系。某溶質的質量分數只能在一定范圍內有意義。例如,在20 ℃時,氯化鈉的水溶液最大質量分數不能超過26.5%。離開實際可能性,討論更大質量分數的氯化鈉溶液是沒有意義的。
3.關于溶質的質量分數的計算,大致包括以下四種類型:
(1)已知溶質和溶劑的量,求溶質的質量分數;
(2)要配制一定量的溶質的質量分數一定的溶液,計算所需溶質和溶劑的量;
(3)溶液稀釋和配制問題的計算;
(4)把溶質的質量分數運用于化學方程式的計算。
教材從學生最熟悉的“咸”、“淡”談起,直接引出“濃”和“稀”的問題。繼而以糖水為例把宏觀的“甜”跟微觀糖分子的多少聯系起來,使“濃”、“稀”形象化。在這個基礎上來闡明溶液組成的含義,使感性的認識上升為理性知識,學生易于接受。
例如:若溶質的量不變,溶劑的量減少,溶液的量如何變化?溶液的組成如何變化?
若溶質的量不變,溶劑量增加,則溶液量的變化如何?溶液組成變化如何?若溶質量增加且完全溶解,溶劑量不變,則溶液量的變化如何?溶液組成變化如何?若溶質質量減少,溶劑量不變,則溶液量的變化如何?組成怎樣變化?等等。這些判斷并不困難,然而是否有意識地進行過這些訓練,會在做溶液中溶質的質量分數的計算題時,效果是大不一樣的。
關于溶質的質量分數的計算的教學建議
溶解度與溶質的質量分數的比較
比較項目
溶解度
溶質的質量分數
意義
表示物質溶解性的度量,受到外界溫度、壓強等影響。
表示溶液中溶質質量的多少,不受外界條件限制。
溫度要求
一定
不一定
溶劑量要求
100g
不一定
溶液是否飽和
一定達到飽和
不一定
單位
g
無
關系式
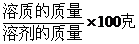
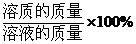
活動與探究(在分別裝10ml水的試管中,分別加入下列物質)
實驗步驟
現象
溶劑質量
溶質質量
溶液質量
溶質質量分數
0.5g硫酸銅
1g硫酸銅
1.5g硫酸銅
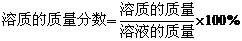
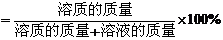
按下表配制改氯化鈉溶液
溶質質量
溶劑質量
溶質質量
溶質質量分數
10g
90g
20g
80g
【講解】1.溶質的質量分數的定義式的意義。
2.定義式中各質量的單位以及溶質的質量分數的單位。
【討論】⑴在不飽和溶液中增加溶質的質量將引起哪些量的變化?怎樣變?
⑵在不飽和溶液中增加溶劑的質量將引起哪些量的變化?怎樣變?
⑶如何使原有溶液中溶質的質量分數增大或減小?
【講解】⑴在不飽和溶液中增加溶質的質量將使溶液的質量和溶質的質量分數增大。
⑵在不飽和溶液中增加溶劑的質量將使溶液的質量增大,使溶質的質量分數減小。
⑶增加溶質的質量,可以使溶質的質量分數增大;增加溶劑的質量,可以使溶質的質量分數減小。反之,減少溶質的質量,可以使溶質的質量分數減小;減少溶劑的質量,可以使溶質的質量分數增大。
溶液稀釋的計算
將濃度大的溶液變成濃度小的溶液叫溶液的稀釋。
【提問】將1克蔗糖放入燒杯中,加入9毫升水,用玻璃棒攪拌至溶解。所得糖水中溶質的質量分數是多少?再向上述糖水中加入10毫升水,攪勻后的糖水中溶質的質量是多少?糖水中溶質的質量分數又是多少?
【講解】根據學生的回答講解溶液在稀釋時溶質的質量是不變的。
【板書】
溶液在稀釋時溶質的質量是不變的。
【講述】溶液的稀釋有加水稀釋和加濃度小的溶液稀釋。有關的計算如下:
【板書】
濃溶液的質量×濃溶液中溶質的質量分數==稀溶液的質量×稀溶液中溶質的質量分數
【講解】稀溶液的質量等于濃溶液的質量和所加水的質量之和。
例:把50克質量分數為98%的硫酸溶液,稀釋成質量分數為20%的硫酸溶液,需要加多少水?
解:設稀釋后硫酸的質量為x
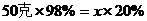
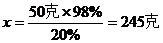
需要加水的質量是: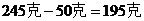
答:需要加水195克。
例:要配制20%的NaOH溶液300 g,需NaOH和水各多少克?
溶質質量(NaOH)=300 g×20%=60 g。
溶劑質量(水)=300g -60 g=240 g。
配制步驟:計算、稱量、溶解。
農業生產上,有時用質量分數為10%~20%食鹽溶液來選種,如配制150 kg質量分數為16%的食鹽溶液,需要食鹽和水各多少千克?
解:需要食鹽的質量為:150 kg×16%=24 kg
需要水的質量為:150 kg-24 kg=126 kg
答:配制150 kg16%食鹽溶液需食鹽24 kg和水126 kg。
【講解】在進行溶質的質量分數的計算時,需要用有關的質量來進行計算,不能用溶液的體積直接進行計算。
溶液的配制步驟
a.計算 b.稱取或量取溶質 c.溶解 d.裝瓶、貼標簽
實驗9-7:配制50g溶質質量分數6%的氯化鈉溶液。
步驟
具體作法
計算
氯化鈉 g,水 ml
稱量
用托盤天平稱取 g氯化鈉,倒入燒杯中
量取
用量筒量取 ml的水倒入燒杯中
溶解
用 攪拌,使氯化鈉溶解
裝瓶、貼標簽
把氯化鈉溶液裝入試劑瓶,蓋好 并
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com