
科目: 來源: 題型:選擇題
| A. | 含4molSi-O鍵的二氧化硅晶體中氧原子數為2NA | |
| B. | 標準狀況下,含3NA個σ鍵的甲醛分子所占的體積約為22.4L | |
| C. | 2molNO和1molO2混合,在密閉容器中充分反應,容器內的分子數小于2NA | |
| D. | 1molFe與一定量的硝酸反應,轉移的電子數為0.2NA~0.3NA |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 對于C2H4(g)+H2O(g)?C2H5OH(g),在一定條件下達到平衡狀態時,體系的總壓強為P,其中C2H4(g)、H2O(g)、C2H5OH(g)均為1mol,則用分壓表示的平衡常數Kp=$\frac{3}{P}$ | |
| B. | 恒溫恒壓下,在一容積可變的容器中,反應2A(g)+B(g)?2C(g)達到平衡時,A、B和C的位置的量分別為4mol、2mol和4mol,若此時A、B和C均增加1mol,平衡正向移動 | |
| C. | 恒溫恒壓下,在一容積可變的容器中,N2(g)+3H2(g)?2NH3(g)達到平衡狀態時,N2、H2、NH3各1mol,若此時再充入3molN2,則平衡正向移動 | |
| D. | 對于一定條件下的某一可逆反應,用平衡濃度表示的平衡常數和平衡分壓表示的平衡常數,其數值不同,但意義相同,都只與溫度有關 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:選擇題
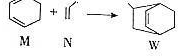 下列說法正確的是( )
下列說法正確的是( )| A. | W的分子式為C9H12 | |
| B. | N分子的所有原子在同一平面上 | |
| C. | M的二氯代物有8種(不考慮立體異構) | |
| D. | M、N、W均可發生氧化反應、還原反應和加聚反應 |
查看答案和解析>>
科目: 來源: 題型:選擇題
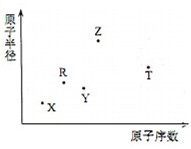 短周期主族元素X、Y、Z、R、T的原子半徑與原子序數關系如圖所示.R原子最外層電子數是電子層數的2倍.Y與Z能形成Z2Y、Z2Y2型離子化合物.Z與T形成的化合物Z2T能破壞水的電離平衡.下列推斷正確的是( )
短周期主族元素X、Y、Z、R、T的原子半徑與原子序數關系如圖所示.R原子最外層電子數是電子層數的2倍.Y與Z能形成Z2Y、Z2Y2型離子化合物.Z與T形成的化合物Z2T能破壞水的電離平衡.下列推斷正確的是( )| A. | 原子半徑和離子半徑均滿足:Y<Z | |
| B. | 氫化物的沸點不一定是:Y>R | |
| C. | 最高價氧化物對應水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四種元素組成的化合物水溶液一定顯堿性 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 核外電子排布完全相同的兩種微粒,其化學性質一定相同 | |
| B. | 凡單原子形成的離子,一定具有稀有氣體元素原子的核外電子排布 | |
| C. | 核外電子排布相同的兩中性原子一定屬于同種元素 | |
| D. | 陰離子的核外電子排布一定與上一周期稀有氣體元素原子的核外電子排布相同 |
查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
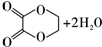 ,B的結構簡式為OGC-CHO.
,B的結構簡式為OGC-CHO.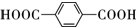
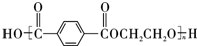 .
.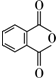 .
.查看答案和解析>>
科目: 來源: 題型:解答題
| X | Y | Z | M | R | Q | |
| 原子半徑/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合價 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常溫下該單質為黃色固體 | 無機非金屬材料的主角 | 焰色反應呈黃色 | 其氧化物可做耐火材料 |
 .
.查看答案和解析>>
科目: 來源: 題型:解答題
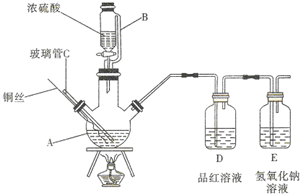 如圖為某實驗小組同學設計的銅與濃硫酸反應的實驗裝置,實驗步驟如下:
如圖為某實驗小組同學設計的銅與濃硫酸反應的實驗裝置,實驗步驟如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com