
科目: 來源: 題型:解答題
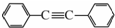 .以互為同系物的單取代芳烴A、G為原料合成M的一種路線(部分反應條件略去)如下:
.以互為同系物的單取代芳烴A、G為原料合成M的一種路線(部分反應條件略去)如下: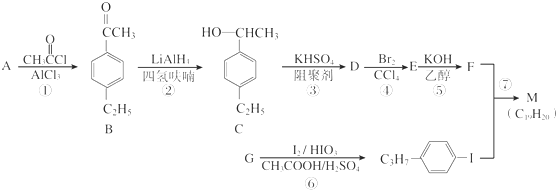
 .
. .
.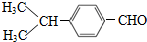 (寫結構簡式).
(寫結構簡式).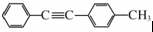 的合成路線:
的合成路線: .
.查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
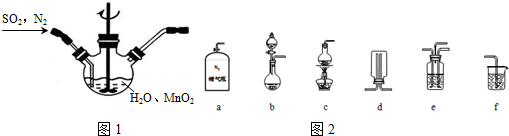
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 原子半徑:Z>Y>X | |
| B. | 最高價氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均滿足8電子的穩定結構 | |
| D. | Y、Z均能與碳元素形成共價化合物 |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 78 g Na2O2中存在的共價鍵總數為NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子數為3.8NA | |
| C. | 氫氧燃料電池負極消耗2.24 L氣體時,電路中轉移的電子數為0.1NA | |
| D. | 0.1 mol氯化鐵溶于1L水中,所得溶液中Fe3+的數目為0.1NA |
查看答案和解析>>
科目: 來源: 題型:選擇題
| A. | 順-2-丁烯和反-2-丁烯的加氫產物不同 | |
| B. | 甲醛、氯乙烯和乙二醇均可作為合成聚合物的單體 | |
| C. | ABS樹脂、光導纖維及碳纖維都是有機高分子材料 | |
| D. | 酸性條件下,C2H5CO18OC2H5的水解產物是C2H5CO18OH和C2H5OH |
查看答案和解析>>
科目: 來源: 題型:解答題
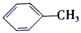 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$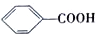
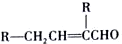
 .
. .
.查看答案和解析>>
科目: 來源: 題型:解答題
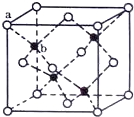 E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于p區的同一周期的元素,M的價層電子排布為ns2np2n,E與M原子核外的未成對電子數相等;QM2與GM2-具有相等的價電子總數;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題:
E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于p區的同一周期的元素,M的價層電子排布為ns2np2n,E與M原子核外的未成對電子數相等;QM2與GM2-具有相等的價電子總數;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題: .E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因:從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性
.E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因:從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性查看答案和解析>>
科目: 來源: 題型:解答題
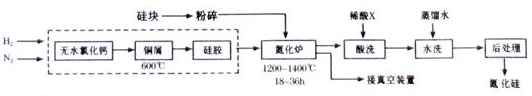
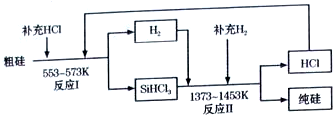
查看答案和解析>>
科目: 來源: 題型:選擇題
| 步驟序號 | 操作步驟 | 現 象 |
| (1) | 用pH試紙檢驗 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振蕩、靜置 | 下層呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀產生 |
| (4) | 過濾,向濾液中加人AgNO3溶液和稀HNO, | 有白色沉淀產生 |
| A. | 不能確定的離子是① | B. | 不能確定的離子是②③ | ||
| C. | 肯定含有的離子是①④⑥ | D. | 肯定沒有的離子是②⑤ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com