
| 步驟序號 | 操作步驟 | 現 象 |
| (1) | 用pH試紙檢驗 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振蕩、靜置 | 下層呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀產生 |
| (4) | 過濾,向濾液中加人AgNO3溶液和稀HNO, | 有白色沉淀產生 |
| A. | 不能確定的離子是① | B. | 不能確定的離子是②③ | ||
| C. | 肯定含有的離子是①④⑥ | D. | 肯定沒有的離子是②⑤ |
分析 (1)用pH試紙檢驗溶液的pH大于7,說明溶液呈堿性,應含有弱酸的酸根離子;
(2)向溶液中滴加氯水,再加入CCl4振蕩,靜置CCl4層呈橙色,說明溶液中含有Br-;
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀產生,該沉淀為BaSO4,但不能確定是否含有SO42-,因SO32-可被硝酸氧化生成SO42-;
(4)過濾,向濾液中加入AgNO3溶液和稀HNO3有白色沉淀產生,該沉淀為AgCl,但不能確定溶液中是否含有Cl-,因所加氯水中含有Cl-.
解答 解:(1)用pH試紙檢驗溶液的pH大于7,說明溶液呈堿性,應含有弱酸的酸根離子,該離子只能為SO32-,則溶液中一定不存在Ba2+,因二者能生成沉淀而不能大量共存,
一定含有Na+,根據溶液呈電中性原則,陽離子只有Na+;
(2)向溶液中滴加氯水,再加入CCl4振蕩,靜置CCl4層呈橙色,說明溶液中含有Br-;
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀產生,該沉淀為BaSO4,但不能確定是否含有SO42-,因SO32-可被硝酸氧化生成SO42-;
(4)過濾,向濾液中加入AgNO3溶液和稀HNO3有白色沉淀產生,該沉淀為AgCl,但不能確定溶液中是否含有Cl-,因所加氯水中含有Cl-.
由以上分析可知,溶液中一定含有的離子為①④⑥,可能含有的離子為③⑤,一定不存在的是②.
故選C.
點評 本題考查離子反應及離子組成分的判斷,題目難度不大,本題注意把握離子的性質及離子共存問題.


科目:高中化學 來源: 題型:選擇題
| A. | 用新制Cu(OH)2懸濁液檢驗乙醛:向10ml10%的硫酸銅溶液中加的2%NaOH溶液4-6滴,振蕩后加入乙醛溶液0.5ml,加熱 | |
| B. | 探究催化劑對H2O2分解速率的影響:在相同條件下,向一支試管中加入2mL5%H2O2和1mLH2O,向另一支試管中加入2mL5%H2O2和1mLFeCl3溶液,觀察并比較實驗現象 | |
| C. | 向盛有過量苯酚濃溶液的試管里逐滴加入稀溴水,邊加邊振蕩,觀察三溴苯酚的生成 | |
| D. | 提純含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入過量飽和氫氧化鈉溶液,振蕩后靜置分液,并除去有機層的水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 污雞凈的主要成分是KMnO4和H2C2O4,可用于洗滌有霉斑的衣物.某小組同學擬探究H2C2O4濃度對反應速率的影響.
污雞凈的主要成分是KMnO4和H2C2O4,可用于洗滌有霉斑的衣物.某小組同學擬探究H2C2O4濃度對反應速率的影響.| 實驗序號 | 溫度/℃ | 各物質的體積/mL | 反應時間 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
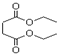
| A. | 1mol琥珀酸二乙酯能與4mol的NaOH反應 | |
| B. | 琥珀酸二乙酯在一定條件下能發生取代、加成和氧化反應 | |
| C. | 琥珀酸的分子式為C4H8O4 | |
| D. | 琥珀酸分子中含有六元環 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
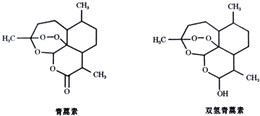
| A. | 青蒿素的分子式為C15H22O5 | |
| B. | 青蒿素和雙氫青蒿素不是同分異構體 | |
| C. | 青蒿素和雙氫青蒿素都能發生酯化反應 | |
| D. | 青蒿素在稀硫酸催化條件下能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 78 g Na2O2中存在的共價鍵總數為NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子數為3.8NA | |
| C. | 氫氧燃料電池負極消耗2.24 L氣體時,電路中轉移的電子數為0.1NA | |
| D. | 0.1 mol氯化鐵溶于1L水中,所得溶液中Fe3+的數目為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1L pH=3的硫酸溶液中,SO42-離子的數目約為5×10-4NA | |
| B. | 1mol氨基(NH2)中含有電子的數目為10NA | |
| C. | 一定條件下,1molN2與3molH2充分反應,轉移電子的數目可能為2NA | |
| D. | 3molNO2和H2O完全反應,被還原的NO2分子數目為1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解精煉銅的過程中,每轉移NA個電子時,陽極溶解銅的質量為32g | |
| B. | 1 molNa2O2固體中含離子總數為4NA | |
| C. | 1mol羥基與17gNH3所含電子數之比為9:10 | |
| D. | 1molNa2CO3晶體中含CO32-離子數小于NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com