
| A. | 原子半徑:Z>Y>X | |
| B. | 最高價氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均滿足8電子的穩定結構 | |
| D. | Y、Z均能與碳元素形成共價化合物 |
分析 短周期主族元素中,W原子的最外層電子數與次外層電子數相等,短周期中只有Be,故W為Be;四元素有兩種為金屬,則X、Y、Z一定處于第三周期,W與Z原子的最外層電子數之和為9,則Z處于ⅦA族,為Cl元素;X與Y原子的最外層電子數之和為9,則X處于ⅢA族、Y處于ⅥA族,故X為Al元素、Y為S元素,據此解答.
解答 解:短周期主族元素中,W原子的最外層電子數與次外層電子數相等,短周期中只有Be,故W為Be;四元素有兩種為金屬,則X、Y、Z一定處于第三周期,W與Z原子的最外層電子數之和為9,則Z處于ⅦA族,為Cl元素;X與Y原子的最外層電子數之和為9,則X處于ⅢA族、Y處于ⅥA族,故X為Al元素、Y為S元素.
A.同周期自左而右原子半徑減小,故原子半徑X(Al)>Y(S)>Z(Cl),故A錯誤;
B.Cl元素非金屬性比硫的強,故最高價氧化物的水化物的酸性:Y(S)<Z(Cl),故B錯誤;
C.化合物WZ2為BeCl2,Be原子最外層電子未達到8電子結構,故C錯誤;
D.Y、Z與碳元素分別形成二硫化碳、四氯化碳,均屬于共價化合物,故D正確.
故選:D.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,注意抓住短周期主族元素,“W原子的最外層電子數與次外層電子數相等”是推斷突破口,熟練掌握元素周期律及其應用,難度中等,


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:選擇題
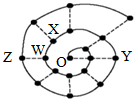 某同學在研究前18號元素時發現,可以將它們排成如下圖所示的“蝸牛”形狀,圖中每個“•”代表一種元素,其中O點(最中心的點)代表起點元素.下列說法中正確的是( )
某同學在研究前18號元素時發現,可以將它們排成如下圖所示的“蝸牛”形狀,圖中每個“•”代表一種元素,其中O點(最中心的點)代表起點元素.下列說法中正確的是( )| A. | 物質YO可能具有較強的氧化性 | |
| B. | 圖中離O點越遠的元素,其原子半徑一定越大 | |
| C. | O2X、WO3分子內都含有氫鍵,所以沸點都較高 | |
| D. | 科學家發現一種新細菌的DNA鏈中有砷(As)元素,該As元素最有可能取代了普通DNA鏈中的Z元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉保存在煤油中 | |
| B. | 工業上金屬Mg、Al都是用電解熔融的氯化物制得的 | |
| C. | 合金的硬度一般比各成分金屬大 | |
| D. | 銅與氯化鐵溶液的反應常用于制作印刷電路板 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉屬于危化品中的易燃固體,其著火時不能用水滅火 | |
| B. | 氰化鈉( NaCN)是一種劇毒危險品,其水溶液呈堿性 | |
| C. | 實驗室里可將少量的鈉保存于煤油中 | |
| D. | NH4N03、NaCN、CaC2中均含有離子鍵和非極性共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=7的溶液中:K+、Na+、Fe3+、SO42- | |
| B. | 飽和NaHCO3溶液中:Al3+、NO3-、I-、Cl- | |
| C. | 水電離產生的c(H+)=10-13 mol•L-1的溶液中:Na+、I-、NO3-、HCO3- | |
| D. | 0.1 mol•L-1FeSO4溶液中:K+、Zn2+、Br-、I- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol羥基(-OH)中所含共價鍵數 | |
| B. | 1molHCl與KClO3反應生成0.5molCl2轉移的電子數 | |
| C. | 1.8 g H2O中所含有的質子數、電子數、中子數 | |
| D. | 常溫常壓下,22.4LNO和CO混合氣體中的O原子個數 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com