
| A. | 1 mol羥基(-OH)中所含共價鍵數 | |
| B. | 1molHCl與KClO3反應生成0.5molCl2轉移的電子數 | |
| C. | 1.8 g H2O中所含有的質子數、電子數、中子數 | |
| D. | 常溫常壓下,22.4LNO和CO混合氣體中的O原子個數 |
分析 A.羥基中含有1個共價鍵,1mol羥基中含有1mol共價鍵;
B.反應中KClO3中Cl元素化合價由+5價降低為Cl2中0價,Cl2是還原產物,而HCl中Cl元素化合價由-1價升高為Cl2中0價,Cl2也是氧化產物,據此計算出生成0.5mol氯氣轉移電子數;
C.水分子中含有的質子數、電子數為10,而含有的中子數為8;
D.常溫常壓下,不是標準狀況下.
解答 解:A.1 mol羥基(-OH)中含有1mol共價鍵,所含共價鍵數NA,故A正確;
B.KClO3+6HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O,反應中KClO3中Cl元素化合價由+5價降低為Cl2中0價,而HCl中Cl元素化合價由-1價升高為Cl2中0價,由方程式可知,生成0.5mol Cl2需要KClO3的物質的量為1mol×$\frac{0.5mol}{3mol}$=$\frac{1}{6}$mol,則轉移電子為$\frac{1}{6}$mol×5=$\frac{5}{6}$mol,不是1mol,故B錯誤;
C.1.8g水的物質的量為0.1mol,0.1mol水分子中含有1mol質子、1mol電子,而含有的中子為0.8mol,故C錯誤;
D.不是標準狀況下,不能使用標準狀況下的氣體摩爾體積計算混合氣體的物質的量,故D錯誤;
故選A.
點評 本題考查阿伏加德羅常數的有關計算和判斷,題目難度中等,注意掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,明確阿伏伽德羅常數的概念及計算方法,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 78克苯中含有碳碳雙鍵的數目為3NA | |
| B. | 1molCl2與足量的鐵反應,轉移的電子數為3NA | |
| C. | 標準狀況下,2.24LCCl4所含分子數為0.1NA | |
| D. | 0.2mol金屬鈉與足量的O2反應,產物中離子數為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:Z>Y>X | |
| B. | 最高價氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均滿足8電子的穩定結構 | |
| D. | Y、Z均能與碳元素形成共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 簡單離子半徑:W>Y>X | |
| B. | Z與W形成的化合物在熔融狀態下能導電 | |
| C. | 電解Y、W形成的化合物,無論是熔融狀態下還是水溶液中,都能得到單質W | |
| D. | 單質X與單質Y加熱條件下能生成白色固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
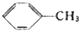 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$ $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$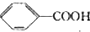
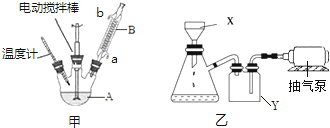
| 名稱 | 相對分子質量 | 性狀 | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 92 | 無色液體、易燃、易揮發 | -95 | 110.6 | 不溶 | 互溶 |
| 苯甲酸 | 122 | 白色片狀或針狀晶體 | 112.4(100℃升華) | 248 | 微溶 | 易溶 |
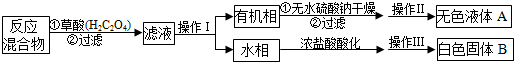
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D |
 |  |  | 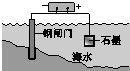 |
| 鋼鐵表面水膜的酸性很弱或呈中性,發生吸氧腐蝕 | 鋼鐵表面水膜的酸 性較強,發生析氫 腐蝕 | 將鋅板換成銅板對 鋼閘門保護效果更好 | 鋼閘門作為陰極而受到保護 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 與H2化合時,X單質比Y單質容易 | |
| B. | X的最高價氧化物的水化物的酸性比Y的最高價氧化物的水化物的酸性強 | |
| C. | X原子的原子序數比Y原子的原子序數大 | |
| D. | X單質可以把Y從其氫化物中置換出來 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單位時間內生成 n mol A2,同時生成 n mol AB | |
| B. | 體系內的總壓不隨時間變化 | |
| C. | 單位時間內生成2n mol AB的同時生成n mol B2 | |
| D. | 單位時間內生成 n mol A2的同時,生成n mol B2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com