
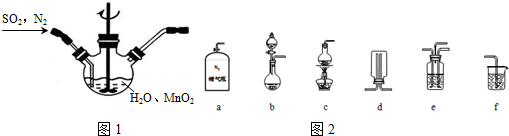
分析 (1)①增大接觸面積,反應速率加快,提高混合其中N2比例,二氧化硫的濃度減小;
②b裝置制備二氧化硫,氮氣與二氧化硫通過e裝置混合,在圖1裝置中反應生成MnSO4,利用f進行尾氣處理,防止污染空氣;
③氧氣能與亞硫酸反應生成硫酸;
(2)步驟②為洗滌雜質,防止氧化與溶解損失;
(3)利用MnCO3轉化為NiCO3淺綠色固體設計;
(4)測定0.1mol/L的硫酸氫鈉溶液的pH或Na2SO4溶液pH.
解答 解:(1)①MnO2研磨、反應時攪拌均可以增大接觸面積,加快反應速率,提高混合其中N2比例,二氧化硫的濃度減小,反應速率減小,
故選:AB;
②反應不需要加熱制備二氧化硫,b裝置制備二氧化硫,氮氣與二氧化硫通過e裝置混合,在圖1裝置中反應生成MnSO4,利用f進行尾氣處理,防止尾氣中二氧化硫污染空氣,
故選:abef;
③制備原理為:H2SO3+MnO2═MnSO4+H2O,若用空氣代替N2進行實驗,氧氣能與亞硫酸反應生成硫酸,二氧化硫利用率降低,
故答案為:空氣中的O2能氧化H2SO3,使SO2利用率下降;
(2)步驟②為洗滌雜質,MnCO3為白色粉末,不溶于水和乙醇,在潮濕環境下易被氧化,應用乙醇洗滌,可以防止被氧化,因溶解導致的損失,
故答案為:乙醇;
(3)先向少量NiSO4溶液中滴加幾滴Na2CO3溶液,生成淺綠色沉淀,再滴加足量MnSO4溶液,沉淀變成白色,可證明KSP(MnCO3)<KSP(NiCO3),
故答案為:向少量NiSO4溶液中滴加幾滴Na2CO3溶液,生成淺綠色沉淀,再滴加足量MnSO4溶液,沉淀變成白色;
(4)配制0.1mol/L NaHSO4溶液,測定溶液pH>1,則說明H2SO4的第二步電離不完全,或用pH計測量Na2SO4溶液的pH大于7,也可證明H2SO4的第二步電離不完全,
故答案為:配制0.1mol/L NaHSO4溶液,測定溶液pH>1,說明H2SO4的第二步電離不完全(或用pH計測量Na2SO4溶液的pH大于7).
點評 本題通過制備方案的設計,考查了反應速率影響因素、對原理與裝置的分析評價、物質的分離提純、實驗方案設計等知識,題目難度中等,注意對題目信息的應用,是對學生綜合能力的考查,需要學生具備扎實的基礎,試題培養了學生的化學實驗能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與水反應制乙醇、乙醇與氧氣反應制乙醛都屬于加成反應 | |
| B. | 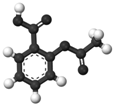 圖為阿司匹林的球棍模型,其分子式是C9H8O4 | |
| C. | CH≡CH通過加聚反應可以得到結構片段為“…-CH=CH-CH=CH-…”的高分子化合物 | |
| D. | 往蛋白質溶液中加入飽和(NH4)2SO4溶液、CuSO4溶液都能產生沉淀,其原理不相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液應保存在帶磨砂玻璃塞的無色細口瓶中 | |
| B. | 二氧化硅是制造光導纖維的材料 | |
| C. | 水玻璃可用作木材防火劑 | |
| D. | 氫氟酸能與二氧化硅反應,因此可用于刻蝕玻璃 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
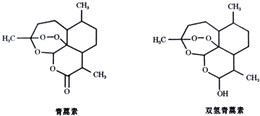
| A. | 青蒿素的分子式為C15H22O5 | |
| B. | 青蒿素和雙氫青蒿素不是同分異構體 | |
| C. | 青蒿素和雙氫青蒿素都能發生酯化反應 | |
| D. | 青蒿素在稀硫酸催化條件下能發生水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于p區的同一周期的元素,M的價層電子排布為ns2np2n,E與M原子核外的未成對電子數相等;QM2與GM2-具有相等的價電子總數;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題:
E、G、M、Q、T是五種原子序數依次增大的前四周期元素.E、G、M是位于p區的同一周期的元素,M的價層電子排布為ns2np2n,E與M原子核外的未成對電子數相等;QM2與GM2-具有相等的價電子總數;T為過渡元素,其原子核外沒有未成對電子.請回答下列問題: .E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因:從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性
.E、M電負性相差1.0,由此可以判斷EM應該為極性較強的分子,但實際上EM分子的極性極弱,請解釋其原因:從電負性分析,CO中的共用電子對偏向氧原子,但分子中形成配位鍵的電子對是由氧原子單方面提供的,抵消了共用電子對偏向O而產生的極性查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1L pH=3的硫酸溶液中,SO42-離子的數目約為5×10-4NA | |
| B. | 1mol氨基(NH2)中含有電子的數目為10NA | |
| C. | 一定條件下,1molN2與3molH2充分反應,轉移電子的數目可能為2NA | |
| D. | 3molNO2和H2O完全反應,被還原的NO2分子數目為1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 結論 |
| A | 將KI和FeCl3溶液在試管中混合后,滴加KSCN溶液 | 溶液變紅色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不變 | 兩者發生的加成反應 |
| C | 向某溶液中滴加稀NaOH溶液,將濕潤紅色石蕊試紙置于試管口 | 試紙不變藍 | 溶液中一定無NH4+ |
| D | 等體積pH=3的HA和HB兩種酸分別與足量的鋅反應,排水法收集氣體 | HA放出的氫氣多且反應速率快 | HA酸性比HB強 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
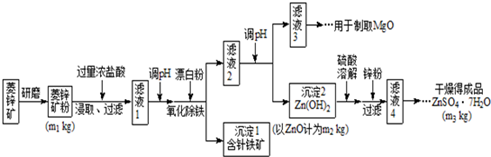
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 開始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 開始溶解的pH | - | 10.5 | - | - |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
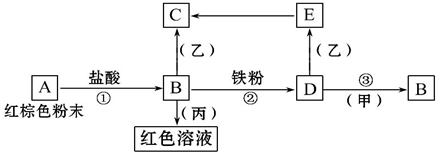 下列物質之間有如下反應關系,已知由E轉化成C的現象是:灰白色沉淀迅速變為灰綠色,最后變為紅褐色.
下列物質之間有如下反應關系,已知由E轉化成C的現象是:灰白色沉淀迅速變為灰綠色,最后變為紅褐色.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com