
 自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:
自然界存在豐富的碳、氮、硅、磷、鐵等元素,它們可形成單質及許多化合物.按要求回答下列問題:分析 (1)依據Fe(CO)5的熔沸點低,且易溶于四氯化碳判斷晶體類型;
(2)鐵的原子序數為26,在周期表中處于第四周期第VIII族;結合亞鐵離子和鐵離子的電子排布式進行判斷;
(3)在“可燃冰”晶體中,每8個籠由46個H2O分子構成框架,其中容納6個CH4分子和2個H2O分子,可判斷每8個籠共48個H2O分子和6個CH4分子,據此推斷可表示可燃冰的平均組成的化學式;
(4)H3PO3與過量NaOH反應充分反應生成亞磷酸氫二鈉(Na2HPO3),則亞磷酸氫二鈉(Na2HPO3)中無可以電離的氫離子;
(5)由金剛石的晶胞結構可知,晶胞內部有4個C原子,面心上有6個C原子,頂點有8個C原子,根據金剛石的結構判斷,在BN晶體中,每個B原子和4個N原子形成共價鍵,B原子的配位數是4,B原子與N原子之間共價鍵的數目是12,一個晶胞中N原子數目為4;根據晶胞結構圖,以晶胞頂點上的氮原子為例,與該氮原子距離最近的氮原子位于經過該頂點的面的面心上;根據$ρ=\frac{m}{ρ}$可計算出晶胞的體積,進而確定晶胞的邊長,最近的兩個N原子間距離是晶胞面對角線的$\frac{1}{2}$,據此計算;
解答 解:(1)Fe(CO)5的熔沸點低,且易溶于四氯化碳,依據分子晶體熔沸點低,且存在相似相溶原理,可知Fe(CO)5為分子晶體;
故答案為:分子晶體;
(2)鐵為26號元素,元素在周期表中位于第四周期Ⅷ族;由于Fe2+的價電子3d6失去一個電子可形成3d5半充滿穩定結構,所以Fe2+易被氧化成Fe3+,
故答案為:第四周期Ⅷ族;Fe2+ 的3d軌道有6個電子,失去1個電子后3d軌道電子排布處于半充滿穩定狀態;
(3)晶體中8個籠只有6個容納CH4分子,另外2個籠被水分子填充,推出8個籠共有6個甲烷分子,46+2=48個水分子,則甲烷分子與水分子的個數之比=6:48=1:8,所以化學式為CH4•8H2O,
故答案為:CH4•8H2O;
(4)H3PO3與過量NaOH反應充分反應生成亞磷酸氫二鈉(Na2HPO3),則亞磷酸氫二鈉(Na2HPO3)中無可以電離的氫離子,為正鹽,
故答案為:正鹽;
(5)由金剛石的晶胞結構可知,晶胞內部有4個C原子,面心上有6個C原子,頂點有8個C原子,在BN晶體中,每個B原子和4個N原子形成共價鍵,B原子的配位數是4,B原子與N原子之間共價鍵的數目是12,所以B原子與N原子之間共價鍵的數目與配位鍵的數目比為 3:1,根據晶胞結構圖,以晶胞頂點上的氮原子為例,與該氮原子距離最近的氮原子位于經過該頂點的面的面心上,這樣的原子有12個,根據均攤可知,一個晶胞中N原子數目為 4,B原子數目也是4,根據$ρ=\frac{m}{V}$可知晶胞的體積V=$\frac{\frac{4b}{6×10{\;}^{23}}}{a}$cm3=$\frac{4b}{6×10{\;}^{23}a}$cm3,所以晶胞的邊長為$\root{3}{\frac{4b}{6×1{0}^{23}a}}$cm,最近的兩個N原子間距離是晶胞面對角線的$\frac{1}{2}$,所以晶體中最近的兩個N原子間距離是$\frac{1}{2}×\sqrt{2}×$$\root{3}{\frac{4b}{6×1{0}^{23}a}}$cm=$\frac{\sqrt{2}}{2}\root{3}{\frac{4b}{6×1{0}^{23}a}}$cm=$\frac{\sqrt{2}}{2}\root{3}{\frac{b}{150a}}$nm,
故答案為:3:1;12;$\frac{\sqrt{2}}{2}\root{3}{\frac{b}{150a}}$;
點評 本題考查了金屬單質及其化合物的綜合應用、晶體結構與性質、晶胞計算等知識,題目難度中等,試題知識點較多、綜合性較強,充分考查學生的分析、理解能力及靈活應用能力,注意掌握常見金屬單質及其化合物的性質,明確均攤法在晶胞計算中的應用.


 提分百分百檢測卷單元期末測試卷系列答案
提分百分百檢測卷單元期末測試卷系列答案科目:高中化學 來源: 題型:解答題
| 實驗操作與現象 | 實驗結論 | |
| 步驟一 | 將該固體全部溶于于得無色溶液; | 肯定無Cu2+. |
| 步驟二 | 向上述溶液中加入足量鹽酸,產生無色無味的氣體共收集到2.24L(標準狀況); | 肯定有CO32- 肯定無Ba2+ |
| 步驟三 | 向步驟二所得溶液中繼續加入足量BaCl2溶液,產生沉淀,過濾并洗滌干燥后得46.6g白色沉淀. | 肯定有SO42- |
| 步驟四 | 向步驟三所得濾液中加入AgNO3溶液,得白色沉淀. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該實驗的整個過程共涉及6個化學反應 | |
| B. | 該實驗的整個過程只涉及1個氧化還原反應 | |
| C. | 混合物中一定有Al、(NH4)2SO4、MgCl2,一定沒有AlCl3、FeCl3 | |
| D. | 混合物中一定有Al、(NH4)2SO4、MgCl2、AlCl3,一定沒有FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 利用微生物電池處理含乙酸鈉和對氯酚
利用微生物電池處理含乙酸鈉和對氯酚 的廢水,工作原理如圖所示.下列說法錯誤的是( )
的廢水,工作原理如圖所示.下列說法錯誤的是( )| A. | 電極b是正極 | B. | 質子從b極移向a極 | ||
| C. | 處理后的廢水pH降低 | D. | a極的電極反應式: +2e-+H+═ +2e-+H+═ +Cl- +Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 立方烷屬于烷烴 | |
| B. | 立方烷的二氯代物有三種同分異構體 | |
| C. | 立方烷在通常情況下是氣體 | |
| D. | 常溫下立方烷能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
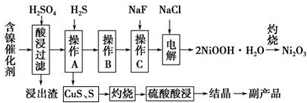 為回收利用廢鎳催化劑(主要成分為NiO,另含Fe2O3、CaO、CuO、BaO等),科研人員研制了一種回收鎳的新工藝.工藝流程如圖:
為回收利用廢鎳催化劑(主要成分為NiO,另含Fe2O3、CaO、CuO、BaO等),科研人員研制了一種回收鎳的新工藝.工藝流程如圖:| 氫氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 開始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸餾時蒸餾燒瓶中液體的體積不能超過容積的$\frac{2}{3}$,液體也不能蒸干 | |
| B. | 給試管中的液體加熱時要不時移動試管,以免暴沸 | |
| C. | 可用稀硝酸鑒別MgI、AgNO3、Na2CO3、NaAlO2四種溶液 | |
| D. | 稀釋濃硫酸時,如果戴有防護眼罩,可以把水慢慢倒入裝有濃硫酸的燒杯中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應可表示為:2A(g)+B(g)?C(g)△H<0 | |
| B. | t℃時該反應的平衡常數K=6.25 | |
| C. | 當容器中氣體密度不再變化時,該反應達到平衡狀態 | |
| D. | t℃,在第6 min時再向體系中充入0.4 mol C,再次達到平衡時C的體積分數大于0.25 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | Al3++H2O?Al(OH)3+H+ | ||
| C. | CH3COOH+NaOH?CH3COONa+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com